
科目: 来源: 题型:
【题目】某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O),设计了如下流程:

下列说法不正确的是( )
A. 溶解烧渣选用足量硫酸,试剂X选用铁粉
B. 固体1中一定含有SiO2,控制pH是为了使Al3+转化为Al(OH)3,进入固体2
C. 从溶液2得到FeSO4·7H2O产品的过程中,须控制条件防止其氧化和分解
D. 若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4·7H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去)。则W、X不可能是( )

选项 | W | X |
A | 稀硫酸 | Na[Al(OH)4]溶液 |
B | 稀硝酸 | Fe |
C | CO2 | Ca(OH)2溶液 |
D | Cl2 | Fe |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述不正确的是( )
A. 用电子式表示HCl的形成过程:![]()
B. ![]() Ho中的原子核内的中子数与核外电子数之差是99
Ho中的原子核内的中子数与核外电子数之差是99
C. 在空气中加热金属锂:4Li+O2![]() 2Li2O
2Li2O
D. Na2O2与H2O2中所含的化学键类型不完全相同
查看答案和解析>>
科目: 来源: 题型:
【题目】已知可逆反应2SO2+O2![]() 2SO3是放热反应,下列说法正确的是( )
2SO3是放热反应,下列说法正确的是( )
A.2 molSO2与1molO2能完全反应生成2 mol SO3,升高温度可以加快此反应的化学反应速率
B.2molSO2与1molO2不能完全反应生成2molSO3,升高温度可以加快此反应的化学反应速率
C.2mol SO2与1 molO2能完全反应生成2molSO3,升高温度减慢此反应的化学反应速率
D.2molSO2与1molO2不能完全反应生成2molSO3,升高温度减慢此反应的化学反应速率
查看答案和解析>>
科目: 来源: 题型:
【题目】用18mol·L-1浓硫酸配制250mL0.9mol·L–1稀硫酸的步骤如下:
①计算所用浓硫酸的体积;②量取一定体积的浓硫酸;③稀释;④ ;⑤转移、洗涤;⑥定容、摇匀;⑦装瓶贴标签
完成下列问题:
(1)计算所需浓硫酸的体积为___。步骤④的内容为___。
(2)容量瓶使用前必须___,容量瓶上需标有以下五项中的___(填序号);
①温度②浓度③容量④压强⑤刻度线
(3)第③步实验的操作中用到的玻璃仪器有___。
(4)下列情况对所配制的稀硫酸浓度有何影响?(选填“偏高”、“偏低”、“无影响”)。
①容量瓶用蒸馏水洗涤后残留有少量的水,则___;
②定容时俯视刻度线,则___。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)过渡态理论认为:化学反应并不是通过简单的碰撞就能完成的,而是从反应物到生成物的过程中经过一个高能量的过渡态。如图是1molNO2与1mol CO恰好反应生成CO2和NO过程中的能量变化示意图。
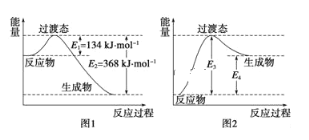
试写出NO2和CO反应的热化学方程式:____,该反应的活化能是____kJmol﹣1。
如图是某学生模仿如图画出的NO(g)+CO2(g)═NO2(g)+CO(g)的能量变化示意图。则图中E3=__kJmol﹣1,E4=__kJmol﹣1。
(2)在密闭容器中充入1mol H2和1mol I2,压强为p(Pa),并在一定温度下使其发生反应:H2(g)+I2(g) ![]() 2HI(g) ΔH<0。保持容器内气体压强不变,向其中加入1molN2,反应速率____(填“变大”、“变小”或“不变”),平衡____移动(填“向正反应方向”、“向逆反应方向”或“不”)。
2HI(g) ΔH<0。保持容器内气体压强不变,向其中加入1molN2,反应速率____(填“变大”、“变小”或“不变”),平衡____移动(填“向正反应方向”、“向逆反应方向”或“不”)。
(3)T℃,向1 L密闭容器中加入1 mol HI(g),发生反应2HI![]() H2+I2,H2物质的量随时间的变化如图所示。
H2+I2,H2物质的量随时间的变化如图所示。
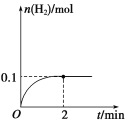
①该温度下,2HI(g) ![]() H2(g)+I2(g)的平衡常数K=____。
H2(g)+I2(g)的平衡常数K=____。
②相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则____是原来的2倍。
a.平衡常数 b.HI的平衡浓度 c.达到平衡的时间 d.平衡时H2的体积分数
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D是中学常见的混合物分离或提纯的基本装置。
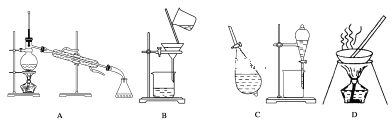
请根据混合物分离或提纯的原理,回答在下列实验中需要使用哪种装置。将A、B、C、D填入适当的空格中。
(1)除去Fe(OH)3胶体中悬浮的Fe(OH)3沉淀___;
(2)从碘水中提取碘___;
(3)用自来水制取蒸馏水___;
(4)除去粗盐中的泥沙___;
(5)与海水晒盐原理相符的是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)在MnO2+4HCl![]() MnCl2+2H2O+Cl2↑反应中。
MnCl2+2H2O+Cl2↑反应中。
①__元素被氧化,__是氧化剂。
②__是氧化产物,__发生氧化反应。
③用“双线桥”法标明电子转移的方向和数目__。
④参加反应的氯化氢和被氧化的氯化氢的物质的量之比__。
(2)现有mg某气体,它是三原子分子,其摩尔质量为Mg·mol-1。若阿伏加德罗常数用NA表示,请用以上符号及相应数字填写下列空格。
①该气体的物质的量为__mol。
②该气体所含原子总数为___个。
③该气体在标准状况下的体积为__L。
④该气体完全溶于水形成VL溶液(不考虑反应),所得溶液的物质的量浓度__mol·L-1。
查看答案和解析>>
科目: 来源: 题型:
【题目】氧化还原反应与四种基本反应类型的关系如图所示,则下列反应属于丙区域的是( )

A.Cl2+2KBr═Br2+2KClB.2NaHCO3![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
C.3Mg+N2![]() Mg3N2D.2Na2O2+2CO2═2Na2CO3+O2
Mg3N2D.2Na2O2+2CO2═2Na2CO3+O2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com