
科目: 来源: 题型:
【题目】(CO2是目前大气中含量最高的一种温室气体。因此,控制和治理CO2是解决温室效应的有效途径。
已知反应Fe(s)+CO2(g)![]() FeO(s)+CO(g)的平衡常数为K1;反应Fe(s)+H2O(g)
FeO(s)+CO(g)的平衡常数为K1;反应Fe(s)+H2O(g)![]() FeO(s)+H2(g)的平衡常数为K2。
FeO(s)+H2(g)的平衡常数为K2。
在不同温度时K1、K2的值如下表:
温度(绝对温度) | K1 | K2 |
973 | 1.47 | 2.38 |
1173 | 2.15 | 1.67 |
(1)写出K2表达式:____。
(2)推导反应CO2(气)+H2(气)![]() CO(气)+H2O(气)的平衡常数K与K1、K2的关系式:__,判断该反应是__反应(填“吸热”或“放热”)。
CO(气)+H2O(气)的平衡常数K与K1、K2的关系式:__,判断该反应是__反应(填“吸热”或“放热”)。
(3)在体积为10L的密闭容器中,加入一定量的CO2和H2(气),在1173K时发生反应CO2(气)+H2(气)![]() CO(气)+H2O(气)并记录前5min的浓度,第6min时改变了反应的条件。各物质的浓度变化如下表:
CO(气)+H2O(气)并记录前5min的浓度,第6min时改变了反应的条件。各物质的浓度变化如下表:
时间/min | CO2(mol/L) | H2(mol/L) | CO(mol/L) | H2O(mol/L) |
0 | 0.2000 | 0.3000 | 0 | 0 |
2 | 0.2740 | 0.0260 | 0.0260 | |
3 | c1 | c2 | c3 | c3 |
4 | c1 | c2 | c3 | c3 |
5 | 0.0727 | 0.1727 | 0.1273 | 0.1273 |
6 | 0.0350 | 0.1350 | 0.1650 |
①前2min,用CO表示的该化学反应的速率是:_____。
②在0~5min之间,达平衡时CO2的转化率为____。
③第6min时,平衡向____方向(填“正反应”或“逆反应”)移动,可能的原因是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)以甲烷、氧气为原料,KOH溶液作为电解质构成燃料电池,总反应式为____,如果以该燃料电池为电源,石墨作两极电解饱和食盐水,则该电解过程中阳极的电极反应式为:____;如果电解一段时间后NaC1溶液的体积为1L,溶液中的OH﹣物质的量浓度为0.01molL﹣1(25℃下测定),则理论上消耗氧气的体积为____mL(标况下)。
(2)用铂电极电解CuSO4溶液,当C(Cu2+)降至原来的一半时停止通电,则加入下列物质中的__ (填序号)物质能使溶液恢复成原来浓度;
A.CuO B.Cu(OH)2 C.Cu D.H2O
电解后电解质溶液的pH值__(填“增大”“减小”或“不变”);写出电解总离子方程式____。
(3)用Pt作电极电解硝酸银溶液,如图甲所示,则左边Pt电极名称是__;发生的电极反应式为__。
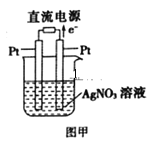
查看答案和解析>>
科目: 来源: 题型:
【题目】某小组同学为探究 H2O2、 H2SO3、 Br2 氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。
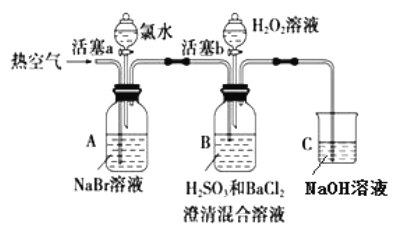
实验记录如下:
实验操作 | 实验现象 | |
① | 打开活塞 a,滴加氯水,关闭活塞 a | _____________________________________________ |
② | 吹入热空气一段时间后停止 | A中溶液颜色明显变浅;B中有气泡,产生大量白色沉淀,沉降后上层清液为无色 |
③ | 打开活塞b,逐滴加入H2O2溶液 | 开始时溶液颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成橙红色。 |
完成下列填空:
(1)在进行操作①时,A中的实验现象是___________,有关反应的离子方程式是___________。
(2)操作②吹入热空气的目的是____________。B 中产生白色沉淀的化学式是___________。
(3)装置C的作用是____________________。
(4)由上述实验可知,在此实验条件下,H2O2、H2SO3、Br2氧化性强弱顺序为________________。
(5)操作③开始时颜色无明显变化可能原因是(写出一条即可):___________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学用如图所示做水果电池的实验,测得数据如下表所示:
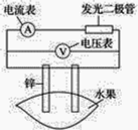
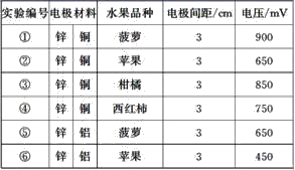
请回答以下问题:
(1)实验⑥中负极的电极反应式为_____________。
(2)实验①、⑤中电流方向相反的原因是_________。
(3)若在实验中发光二极管不亮,该同学用铜、锌作电极,用菠萝作介质,并将多个此电池串联起来,再接发光二极管,这样做________(填“合理”或“不合理”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下表标出的是元素周期表的一部分元素,回答下列问题:
1 | ||||||||||||||||||
2 | A | B | C | |||||||||||||||
3 | D | E | F | G | H | I | J | K | ||||||||||
4 | M | |||||||||||||||||
(1)在上表用字母标出的12种元素中,化学性质最不活泼的是____(用元素符号表示,下同),属于过渡元素的是___(该空格用表中的字母表示)。
(2)为比较元素A和G的非金属性强弱,用下图所示的装置进行实验(夹持仪器已略去,装置气密性良好)。溶液B应该选用_____溶液,作用是_____,能说明A和G非金属性强弱的化学方程式是______。
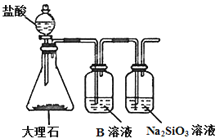
(3)J的氢化物的电子式为____,最高价氧化物对应的水化物的化学式为_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】汽车尾气中CO、NOx以及燃煤废气中的SO2都是大气污染物,对它们的治理具有重要意义。
(1)氧化还原法消除NOx的转化如下所示:NO![]() NO2
NO2![]() N2
N2
①反应Ⅰ为NO+O3===NO2+O2,生成标准状况下11.2 L O2时,转移电子的物质的量是 __________mol。
②反应Ⅱ中,当n(NO2)∶n[CO(NH2)2]=3∶2时,氧化产物与还原产物的质量比为____。
(2)使用“催化转化器”可以减少尾气中的CO和NOx,转化过程中发生反应的化学方程式为CO+NOx→N2+CO2(未配平),若x=1.5,则方程式中CO2和N2的化学计量数之比为______。
(3)吸收SO2和NO,获得Na2S2O4和NH4NO3产品的流程图如图所示(Ce为铈元素)。
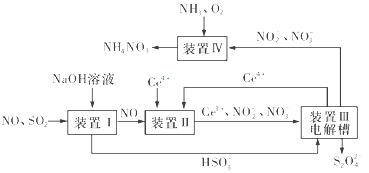
装置Ⅱ中,酸性条件下NO被Ce4+氧化的产物主要是NO3-和NO2-,请写出生成等物质的量的NO3-和NO2-时的离子方程式:________。
(4)已知进入装置Ⅳ的溶液中NO2-的浓度为a g·L-1,要使1 m3该溶液中的NO2-完全转化为NH4NO3,至少需向装置Ⅳ中通入标准状况下的氧气____L(用含a代数式表示,结果保留整数)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列描述与图象相对应的是
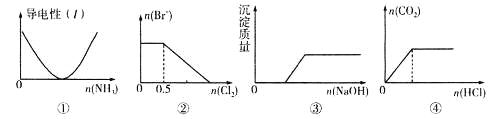
A.图①表示向乙酸溶液中通入氨气至过量的过程中溶液导电性的变化
B.图②表示向1 L l mol·L-1FeBr2溶液中通入Cl2时Br-物质的量的变化
C.图③表示向Ca(HCO3)2溶液中滴加NaOH溶液时沉淀质量的变化
D.图④表示向一定浓度的Na2CO3溶液中滴加盐酸,生成CO2的物质的量与滴加盐酸物质的量的关系
查看答案和解析>>
科目: 来源: 题型:
【题目】在下列各图曲线中分别表示物质的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质),下列选项中的对应关系错误的是

A. 图①可以表示F-、Na+、Mg2+、Al3+四种离子的离子半径大小关系
B. 图②可以表示ⅡA族元素的最外层电子数
C. 图③可以表示ⅥA族元素氢化物的沸点高低关系
D. 图④可以表示第三周期中的非金属元素对应单质的熔点高低关系
查看答案和解析>>
科目: 来源: 题型:
【题目】恒温恒容下反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),能说明反应达到平衡状态的是( )
CH3OH(g)+H2O(g),能说明反应达到平衡状态的是( )
A.混合气体中H2O的体积分数保持不变
B.混合气体的密度不随时间的变化而变化
C.单位时间内消耗3 molH2,同时生成1 mol CH3OH
D.反应中CO2与CH3OH的物质的量浓度之比为1:1
查看答案和解析>>
科目: 来源: 题型:
【题目】一定量的铁、铝合金与300mL 2mol/L硝酸完全反应生成3.36LNO(标况)和三价铁盐、铝盐等,再向反应后的溶液中加入3mol/L的NaOH溶液,使铝、铁元素完全沉淀下来,则所加NaOH溶液的体积是( )
A. 450mL B. 150mL C. 200mL D. 无法计算
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com