
科目: 来源: 题型:
【题目】纳米材料一直是人们研究的重要课题,例如纳米级Fe粉表面积大,具有超强的磁性,高效催化性等优良的性质。
I、实验室采用气相还原法制备纳米级Fe,其流程如图所示:
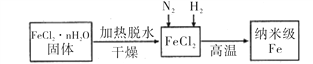
(1)纳米级Fe和稀盐酸反应的离子方程式为_______________________________。
(2)如何将FeCl2·nH2O固体加热脱水制得无水FeCl2 _____________________________________(用简要文字描述)。
(3)生成纳米级Fe的化学方程式为______________________________________。
II、查阅资料:在不同温度下,纳米级Fe粉与水蒸气反应的固体产物不同,温度低于570℃时生成FeO,高于570℃时生成Fe3O4。甲同学用如图甲装置所示进行纳米级Fe粉与水蒸气反应的实验,乙同学用图乙所示的装置进行纳米级Fe粉与水蒸气的反应并验证产物。

(4)甲装置中纳米级Fe粉与水蒸气反应的化学方程式是 ______________________。
(5)甲装置中仪器a的名称为_______________________。
(6)乙同学为探究实验结束后试管内的固体物质成分,进行了下列实验:
实验步骤 | 实验操作 | 实验现象 |
I | 将反应后得到的黑色粉末X(假定为均匀的),取出少量放入另一试管中,加入少量盐酸,微热 | 黑色粉末逐渐溶解,溶液呈浅绿色;有少量气泡产生 |
II | 向实验I得到的溶液中滴加几滴KSCN溶液,振荡 | 溶液没有出现红色 |
根据以上实验,乙同学认为该条件下反应的固体产物为FeO。
丙同学认为乙同学的结论不正确,他的理由是______(用简要文字描述)。
(7)丁同学称取5.60gFe粉,用乙装反应一段时间后,停止加热。将试管内的固体物质在干燥器中冷却后,称得质量为6.88g,则丁同学实验后的固体物质中氧化物的质量分数为________(结果保留三位有效数字)。
查看答案和解析>>
科目: 来源: 题型:
【题目】环之间公用一个碳原子的化合物称为螺环化合物,螺[2,2]戊烷(![]() )是最简单的一种。下列关于该化合物的说法错误的是( )
)是最简单的一种。下列关于该化合物的说法错误的是( )
A. 与环戊烯互为同分异构体B. 二氯代物超过两种
C. 生成C5H12时至少需要2molH2D. 所有碳原子均处于同一平面
查看答案和解析>>
科目: 来源: 题型:
【题目】现有一种有机物M,其结构简式为![]() ,M的同分异构体有多种,符合下列条件的同分异构体有( )
,M的同分异构体有多种,符合下列条件的同分异构体有( )
①六元环上有3个取代基,②官能团不变,③两个基团不连接在同一个碳原子上。
A. 9种B. 10种C. 11种D. 12种
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物a、b、c在一定条件下的转化关系如图所示。下列说法正确的是
![]()
A. a中所有碳原子处于同一平面
B. b可用于萃取溴水中的溴
C. ①②均属于加成反应
D. 等物质的量的b、c分别完全燃烧,耗氧量相等
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)X射线衍射测定等发现,I3AsF6中存在I3+离子。I3+离子的几何构型为____,中心原子的杂化形式为______。
(2)丙酮(![]() )分子中碳原子轨道的杂化类型是_______,1mol丙酮分子中含有σ键的数目为_________。
)分子中碳原子轨道的杂化类型是_______,1mol丙酮分子中含有σ键的数目为_________。
(3)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是___________。
②在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为_____,提供孤电子对的成键原子是__________
③氨的沸点____(填“高于”或“低于”)膦(PH3),原因是______。氨是______分子(填“极性”或“非极性”),中心原子的轨道杂化类型为_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】铜有两种常见的氧化物CuO和Cu2O。某学习小组取0.98 g(用精密天平测量)Cu(OH)2固体加热,有铜的氧化物生成,其质量随温度变化如图1所示;另外,某同学绘制了三条表示金属氧化物与其所含金属元素质量的关系曲线,如图2所示。则下列分析正确的是( )
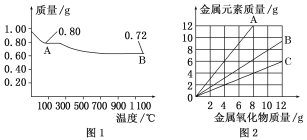
A. 图1中,A到B的过程中有0.005 mol电子发生了转移
B. 图1整个过程中共生成0.18 g水
C. 图2三条曲线中,表示CuO和其中所含Cu元素质量关系的曲线是A
D. 图1中A和B化学式分别为Cu2O和CuO
查看答案和解析>>
科目: 来源: 题型:
【题目】化学反应伴随能量变化,其中能量的主要形式是热能。
I:如图所示,把试管放入盛有25℃饱和澄清石灰水的烧杯中,往试管中放入几小块镁片,再用滴管滴入5mL盐酸于试管中,试回答下列问题:
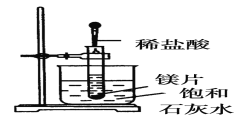
(1)实验中观察到的现象是________________________。
(2)产生上述现象的原因是________________________。
(3)写出有关反应的离子方程式__________________________。
(4)由实验推知,MgCl2和H2的总能量________(填“大于”“小于”或“等于”)镁片和HCl的总能量。
II:从能量变化的角度研究反应:2H2+O2=2H2O。
(1)如图能正确表示该反应中能量变化的是_________。
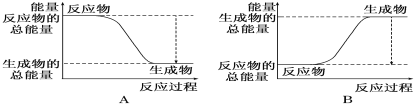
(2)已知断开或形成1 mol化学键吸收或放出的能量,叫做该化学键的键能,单位为kJ·mol-1。一些键能数据如下表:
化学键 | H—H | O=O | H—O |
键能(kJ·mol-1) | 436 | 496 | 463 |
请回答:
断裂反应物2 mol H2和1 mol O2的化学键,需要_______的总能量为______kJ;形成生成物2 mol H2 O的化学键,需要______的总能量为______kJ。所以该反应能量变化值的大小 ____________ kJ(填数值)。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)基态K原子中,核外电子占据最高能层的符号是____,占据该能层电子的电子云轮廓图形状为______。
(2)基态Ge原子的核外电子排布式为[Ar]_______,有______个未成对电子。
(3)写出基态As原子的核外电子排布式____。根据元素周期律,原子半径Ga___As,第一电离能Ga____As。(填“大于”或“小于”)
(4)Zn2+基态核外电子排布式为____________________。
(5)氮原子价层电子的轨道表达式(电子排布图)为_____________。
(6)CH4和CO2所含的三种元素电负性从小到大的顺序为________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】[化学—选修3:物质结构与性质](15分)A、B、C、D为原子序数依次增大的四种元索,A2-和B+具有相同的电子构型;C、 D为同周期元索,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是 (填元素符号),其中C原子的核外电子排布式为__________。
(2)单质A有两种同素异形体,其中沸点高的是 (填分子式),原因是 ;A和B的氢化物所属的晶体类型分别为 和 。
(3)C和D反应可生成组成比为1:3的化合物E, E的立体构型为 ,中心原子的杂化轨道类型为 。
(4)化合物D2A的立体构型为 ,中心原子的价层电子对数为 ,单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为 。
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数,a=0.566nm, F 的化学式为 :晶胞中A 原子的配位数为 ;列式计算晶体F的密度(g.cm-3) 。
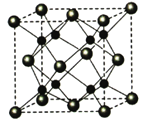
查看答案和解析>>
科目: 来源: 题型:
【题目】新型储氢材料是开发利用氢能的重要研究方向.
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得.
①基态Cl原子中,电子占据的最高电子层符号为__________,该电子层具有的原子轨道数为______.
②LiBH4由Li+和BH![]() 构成,BH
构成,BH![]() 的立体构型是______,B原子的杂化轨道类型是_______.
的立体构型是______,B原子的杂化轨道类型是_______.
③Li、B元素的电负性由小到大的顺序为_______________________.
(2)金属氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径:Li+________H-(填“>”“=”或“<”).
②某储氢材料是短周期金属元素M的氢化物. M的部分电离能如下表所示:
I1/kJ·mol-1 | I2/kJ·mol-1 | I3/kJ·mol-1 | I4/kJ·mol-1 | I5/kJ·mol-1 |
738 | 1 451 | 7 733 | 10 540 | 13 630 |
M是________族元素.
(3)NaH具有NaCl型晶体结构,已知NaH晶体的晶胞参数a=488 pm,Na+半径为102 pm,H-的半径为142pm,NaH的理论密度是________g·cm-3.(仅写表达式,不计算)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com