
科目: 来源: 题型:
【题目】元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4-(绿色)、Cr2O72-(橙红色)、CrO42-(黄色)等形式存在, CrO42-和Cr2O72-在溶液中可相互转化2CrO42-+2H+![]() Cr2O72-+H2O。 室温下,初始浓度为1.0mol/L的Na2CrO4溶液中c(Cr2O72-)随c(H+)的变化如图所示,回答下列问题:
Cr2O72-+H2O。 室温下,初始浓度为1.0mol/L的Na2CrO4溶液中c(Cr2O72-)随c(H+)的变化如图所示,回答下列问题:

(1)由图可知,随着溶液酸性增强,CrO42-的平衡转化率__________(填“增大“减小”或“不变”)。根据A(1.0,0.25)点数据,计算出该转化反应的平衡常数为__________。
(2)升高温度,溶液中CrO42-的平衡转化率减小,则该反应的ΔH_______0(填“大于”“小于”或“等于”)。
(3) 在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中的Cl-,利用Ag+与CrO42-生成砖红色沉淀,指示到达滴定终点。当溶液中Cl-恰好完全沉淀(浓度等于1.0×10-5mol/L)时,溶液中c(Ag+)为_______ mol/L,此时溶液中c(CrO42-)等于__________ mol/L。 (已知Ag2CrO4、AgCl的Ksp分别为2.0×10-12和2.0×10-10)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某溶液由Na+、Cu2+、Ba2+、Fe3+、AlO![]() 、CO
、CO![]() 、SO
、SO![]() 、Cl中的若干种离子组成,取适量该溶液进行如下实验:下列说法正确的是
、Cl中的若干种离子组成,取适量该溶液进行如下实验:下列说法正确的是

A. 原溶液中一定只存在![]() 、
、![]() 、
、![]() 、Cl-四种离子
、Cl-四种离子
B. 气体A的化学式是CO2,其电子式为O::C::O
C. 原溶液中一定不存在的离子是Cu2+、Ba2+、Fe3+
D. 生成沉淀B的离子方程式为:Al3++3OH===Al(OH)3↓
查看答案和解析>>
科目: 来源: 题型:
【题目】美国普度大学研究开发出一种利用铝镓合金制备氢气的新工艺(如图所示)。下列有关该工艺的说法错误的是( )

A.铝镓合金可以循环使用
B.该过程中,能量的转化形式只有两种
C.铝镓合金与水反应的化学方程式为:2Al+3H2O  Al2O3+3H2↑
Al2O3+3H2↑
D.总反应式为2H2O 2H2↑+O2↑
2H2↑+O2↑
查看答案和解析>>
科目: 来源: 题型:
【题目】青蒿素是烃的含氧衍生物,为无色针状晶体,易溶于丙酮、氯仿和苯中,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156~157℃,热稳定性差,青蒿素是高效的抗疟药,已知:乙醚沸点为35℃,从青蒿中提取青蒿素的方法之一是以萃取原理为基础的,主要有乙醚浸取法和汽油浸取法,乙醚浸取法的主要工艺为(如图):
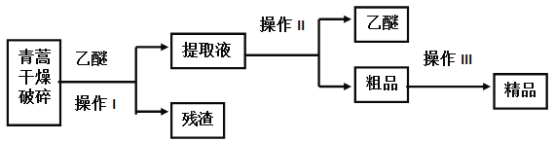
请回答下列问题:
(1)对青蒿进行干燥破碎的目的是 _______________________________。
(2)操作I需要的玻璃仪器主要有:烧杯、玻璃________ ,操作Ⅱ的名称是__________。
(3)通常用燃烧的方法测定有机物的分子式,可在燃烧室内将有机物样品与纯氧在电炉加热下充分燃烧,根据产品的质量确定有机物的组成,如图所示的是用燃烧法确定青蒿素分子式的装置:

①按上述所给的测量信息,装置的连接顺序应是_____________。(装置可重复使用)
②青蒿素样品的质量为28.2g,用合理改进后的装置进行试验,称得A管增重66g,B管增重19.8g,则测得青蒿素的最简式是_________________。
③要确定该有机物的分子式,还必须知道的数据是__________________________。
(4)某学生对青蒿素的性质进行探究.将青蒿素加入含有NaOH、酚酞的水溶液中,青蒿素的溶解量较小,加热并搅拌,青蒿素的溶解量增大,且溶液红色变浅,说明青蒿素与 ________(填字母)具有相同的性质
A.乙醇 B.乙酸 C.葡萄糖 D.乙酸乙酯
查看答案和解析>>
科目: 来源: 题型:
【题目】目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应CO2(g)+3H2(g)CH3OH(g)+H2O(g),图甲表示该反应过程中能量的变化。
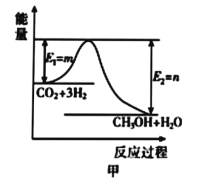
(1)在固定容积的密闭容器内,下列能说明该反应已经达到平衡状态的是______。
A.单位时间内生成n mol CO2的同时生成 3n molH2
B.容器内气体压强保持不变
C.v逆(CO2)=v正(CH3OH)
D.1mol CH3OH中H—O键断裂的同时2mol C=O键断裂
E.混合气体的密度不再改变的状态
F.混合气体的平均相对分子质量不变
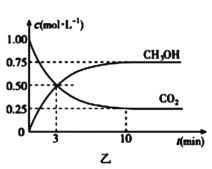
(2)在体积为1 L的密闭容器中,充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化如图乙所示。从反应开始到平衡,用氢气浓度变化表示的平均反应速率v(H2)=_______。容器内平衡时与起始时的压强之比为________。平衡时 CO2的转化率为________,平衡时CH3OH的体积分数为__________。
(3)下图是科学家正在研发的,以实现上述反应[CO2(g)+3H2(g)CH3OH(g)+H2O(g)]在常温常压下进行的装置。写出甲槽的电极反应式:_____________________。

查看答案和解析>>
科目: 来源: 题型:
【题目】为测定某有机化合物A的结构,进行如下实验:
Ⅰ.分子式的确定:
(1)将有机物A置于氧气流中充分燃烧,实验测得生成7.2gH2O和13.2gCO2,消耗氧气10.08L(标准状况),则该物质中各元素的原子个数之比是____________________。
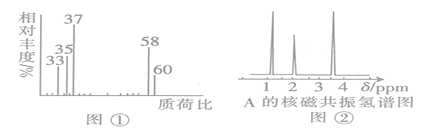
(2)用质谱仪测定该有机化合物的相对分子质量,得到如图①所示质谱图,则其相对分子质量为________,该物质的分子式是_______________。
(3)根据价键理论,预测A可能的结构简式: _________________________。
Ⅱ.结构式的确定:
(4)核磁共振氢谱能对有机物分子中不同位置的氢原子给出不同的峰值(信号),根据峰值可以确定分子中氢原子的种类和数目。经测定,有机物A的核磁共振氢谱如图②,则A的结构简式为___________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】苯甲酸钠(NaA)可作饮料的防腐剂,研究表明苯甲酸(HA)的抑菌能力显著高于A-,在生产碳酸饮料的过程中,除了添加NaA外,还需加压充入CO2。已知25 ℃时,HA、H2CO3的电离平衡常数分别为K=6.25×10-5、 K1=4.3×10-7,则下列说法正确的是(不考虑饮料中其他成分)
A. 提高CO2充气压力,饮料中c(A-)不变
B. 当pH为5.0时,饮料中![]() =0.16
=0.16
C. 相比于未充CO2的饮料,碳酸饮料的抑菌能力较低
D. 结合H+的能力:A->HCO3-
查看答案和解析>>
科目: 来源: 题型:
【题目】如表是元素周期表的一部分,参照元素在表中的位置,回答下列问题:
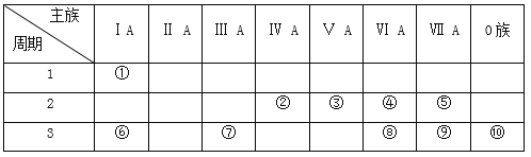
(1)上述元素最高价氧化物对应水化物中,酸性最强的是__________(填化学式),碱性最强的是__________(填化学式),显两性的是__________(填名称)。
(2)气态氢化物中,最稳定的是__________(填化学式),④⑧形成的氢化物中沸点最高的是__________(填化学式),原因是__________________。
(3)④分别和①、⑥两种元素的原子按1:1组成的常见化合物的电子式分别为__________和_______。用电子式表示②和④的三原子分子的形成过程____________。
(4)④⑥⑦⑨的简单离子半径由大到小的顺序为__________(用离子符号和“>”表示)。
(5)⑥和⑦的最高价氧化物对应水化物之间发生反应的化学方程式___________。
(6)为了证明⑥和⑦两种元素的金属性强弱,下列说法或实验能提供证据的是______。
A.比较两种元素的单质的熔点、沸点高低
B.将两种元素的单质分别与冷水反应,观察反应的剧烈程度
C.比较两种元素的最高价氧化物对应的水化物的碱性强弱
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是实验室制取SO 2并验证SO 2的某些性质的装置,请回答:
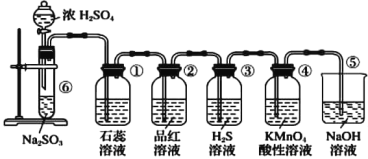
(1)在⑥中发生反应的化学方程式为_____________________。
(2)①中的实验现象为石蕊溶液__________,此实验证明SO 2具有_________的性质。
(3)②中的品红溶液________。
(4)③中发生的化学反应方程式为________________。
(5)④中的实验现象是______________________,证明SO 2有_____________性。
(6)⑤装置的作用是_________,该反应的离子方程式为________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】合成氨反应为:N2(g)+3H2(g)![]() 2NH3(g).图1表示在一定的温度下此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线.图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响.下列说法正确的是
2NH3(g).图1表示在一定的温度下此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线.图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响.下列说法正确的是
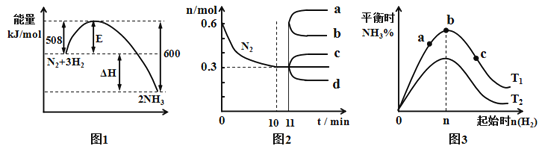
A.由图1可知2NH3(g)![]() N2(g)+3H2(g) △H=-92kJ·mol-1
N2(g)+3H2(g) △H=-92kJ·mol-1
B.图2中0~10min内该反应的平均速率v(H2)=0.09mol·L-1·min-1
C.图2中从11min起其它条件不变,压缩容器的体积,则n(N2)的变化曲线为d
D.图3中温度T1<T2,a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是b点
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com