
科目: 来源: 题型:
【题目】某工厂废水中含游离态氯(即含有氯分子Cl2),通过下列实验测定其浓度:
①取废水样10.0 mL于锥形瓶,加入10.0mL KI溶液(足量),滴入指示剂2~3滴。
②取一滴定管依次用自来水,蒸馏水洗净,然后就注入0.01 mol/L的Na2S2O3标准液,调整液面,记下读数。
③将锥形瓶置于滴定管下进行滴定,发生的反应为I2+2Na2S2O3=2NaI+Na2S4O6(Na2S4O6溶液为无色)。
试回答下列问题:
(1)步骤①加入的指示剂是________________。
(2)步骤①反应的离子方程式是______________________________________。
(3)步骤③当锥形瓶中待测液的颜色由_________________________________即达终点,若耗去Na2S2O3溶液20.00 mL,则废水中Cl2的物质的量浓度为______________。
(4)按照上述实验操作,最后会导致所测得的Cl2的物质的量浓度会比实际浓度_________(填“偏大”、“偏小”或“相等”)。
(5)若读Na2S2O3溶液的体积不规范,没有平视,滴定前仰视,滴定后又俯视,最后会导致所测得的Cl2的物质的量浓度会比实际浓度___________________(填“偏大”、“偏小”或“相等”)。
(6)下列有关滴定实验的说法正确的是_______。
A.检查酸性滴定管是否漏水,关闭活塞,向滴定管中注一定量水,观察尖嘴部分是否滴水
B.用标准液滴定待测液时,滴定前尖管处无气泡,滴定后有气泡,则测定结果偏大
C.酸碱中和反应无明显现象,可以用pH计来指示反应终点
D.滴定过程中滴加溶液速度不能太快,一般以每秒3~4滴为宜
查看答案和解析>>
科目: 来源: 题型:
【题目】某学习小组拟探究CO2和锌粒反应是否生成CO,已知CO能与银氨溶液反应产生黑色固体。实验装置如图所示:下列叙述正确的是

A.装置e的作用是防倒吸
B.根据图a的现象判断活塞K一定处于关闭状态
C.实验结束时,先关闭活塞K,再熄灭酒精灯
D.b、c、f中的试剂依次为饱和碳酸钠溶液、浓硫酸、银氨溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.0.5molFe在O2中燃烧失去的电子数为1.5NA
B.8.7gMnO2与40mL10mol·L-1的浓盐酸充分反应,生成的氯气分子数为0.1NA
C.1molC2H4中所含共用电子对数为6NA
D.1L0.5mol·L-1KHCO3溶液中,阴阳离子总数为1NA
查看答案和解析>>
科目: 来源: 题型:
【题目】如何降低大气中CO2的含量及有效地开发利用CO2是当前科学家研究的重要课题。
(1)利用H2和CO2生产甲醇燃料。为探究该反应原理,进行如下实验:某温度下,在容积为2 L的密闭容器中充入1 mol CO2和3.25 molH2,在一定条件下反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化关系如图所示。
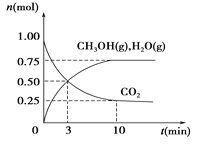
①从反应开始到3min时,氢气的平均反应速率v(H2)=_________。
②下列措施中一定能使CO2的转化率增大的是____________。
A.在原容器中再充入1 molCO2 B.在原容器中再充入1molH2
C.在原容器中充入1 molHe D.使用更有效的催化剂
E.缩小容器的容积 F.将水蒸气从体系中分离出
(2)利用氢气在一定条件下与二氧化碳反应生成乙醇燃料,其热化学反应方程式为2CO2(g)+6H2(g)![]() CH3CH2OH(g)+3H2O(g) ΔH=akJ/mol,在一定条件下,测得该反应达到平衡状态时的实验数据如表所示。请根据表中数据回答下列问题。
CH3CH2OH(g)+3H2O(g) ΔH=akJ/mol,在一定条件下,测得该反应达到平衡状态时的实验数据如表所示。请根据表中数据回答下列问题。
温度(K) CO 2转化率/ (%)
| 500 | 600 | 700 | 800 |
1.5 | 45 | 33 | 20 | 12 |
2 | 60 | 43 | 28 | 15 |
3 | 80 | 61 | 35 | 21 |
①上述反应的a________0(填“大于”或“小于”)。该反应自发的条件是__________(填“高温”,“低温”,或“任意温度”)。
②恒温下,向反应体系中加入固体催化剂,则反应产生的热量________(填“增大”、“减小”或“不变”)。
③在2L密闭容器中充入1molCO2,在![]() =3,500K的温度下达到化学平衡时,则反应的平衡常数是_______________。
=3,500K的温度下达到化学平衡时,则反应的平衡常数是_______________。
(3)锂空气电池是前景很广的新颖电池,但锂和空气中的氮气、二氧化碳、水蒸气等发生副反应是锂-空气电池的致命缺陷。所以应在锂金属电极上加一个保护层。该技术的核心是锂表面增加了一层由碳酸锂/碳(Li2CO3/C)组成的致密的保护性涂层。涂层的过程:利用熔融碳酸盐作电解质,直接由锂金属电极与二氧化碳通过 10 次充放电循环,在电极的表面进行化学反应来完成。写出锂电极生成致密保护涂层的电极反应式___________________。利用一种钾盐水溶液作电解质,CO2电催化还原为乙烯,如图所示。在阴极上产生乙烯的电极反应式为_________________。
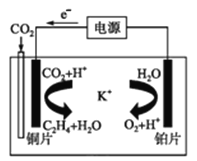
查看答案和解析>>
科目: 来源: 题型:
【题目】A是用于制造汽车发动机的耐高温陶瓷材料,A由两种元素组成,取2.05g A在纯氧中充分反应,得到2.55g固体E和一种气体G。一定条件下,A还存在如下图所示的物质转化关系,其中C、F、K是无色无味的气体单质,D、H是固体单质。反应②常用于汽车尾气的处理。
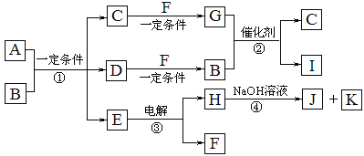
(1)C的电子式_________。
(2)A中所含元素形成的二种简单离子的半径_______大于_______。(填离子符号)
(3)反应②的化学方程式_______________________。
(4)写出反应④的离子方程式_______________________。
(5)A在潮湿的空气里不稳定,产生一种刺激性气味的气体,写出反应的化学方程式_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】新装修的房屋会释放出有毒的甲醛气体。银-Ferrozine法检测甲醛(HCHO)的原理如下(在原电池中完成氧化银与甲醛的反应)。下列说法正确的是

A.理论上消耗HCHO和Fe3+的物质的量之比为4:1
B.30gHCHO被氧化时,理论上电路中通过2mol电子
C.电池正极的电极反应式为Ag2O+2H++2e-=2Ag+H2O
D.其他条件相同,甲醛浓度越大,所得有色配合物溶液的吸光度越小
查看答案和解析>>
科目: 来源: 题型:
【题目】某有机物结构简式如图所示。该物质具有下列的结构和性质,不正确的是( )
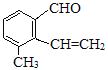
A.最多可以和5molH2发生加成反应
B.所有原子有可能在同一平面内
C.能与Br2在光照下发生取代
D.能与Ag(NH3)2OH溶液发生反应
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上利用无机矿物资源生产部分材料的流程示意图如下。下列说法正确的是
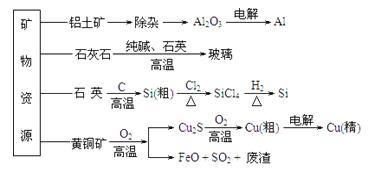
(注:铝土矿中含有A12O3、SiO2、Fe2O3)
A. 在铝土矿制备较高纯度A1的过程中只用到NaOH溶液、CO2气体
B. 石灰石、纯碱、石英、玻璃都属于盐,都能与盐酸反应
C. 在制粗硅时,氧化剂与还原剂的物质的量之比为1∶2
D. 黄铜矿(CuFeS2)与O2反应产生的Cu2S、SO2均只是还原产物
查看答案和解析>>
科目: 来源: 题型:
【题目】利用下图所示的有机物X可生产S诱抗素Y。下列说法正确的是
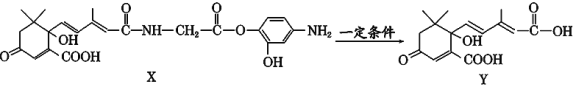
A. X结构中有2个手性碳原子
B. X可以发生氧化、取代、酯化、加聚、缩聚反应
C. Y既可以与FeCl3溶液发生显色反应,又可使酸性KMnO4溶液褪色
D. 1 mol X与足量NaOH溶液反应,最多消耗4 mol NaOH,1 mol Y最多能加成4 molH2
查看答案和解析>>
科目: 来源: 题型:
【题目】溶液 A中可能含有如下离子:Na+、NH4+、Ba2+、Mg2+、SO42-、SO32-、Cl-、OH-。某同学设计并完成了如下的实验:
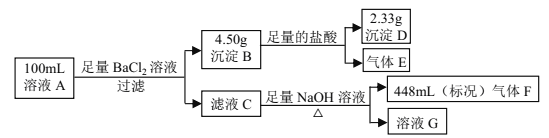
下列说法正确的是
A. 溶液 A 中一定存在 NH4+、 SO42-、 SO32-,可能存在 Na+
B. 溶液 A 中一定存在 NH4+、 Mg2+、 SO42-、 SO32-,可能存在 Cl-
C. 溶液 A 中可能存在 Cl-,且 c(Na+) ≥ 0.20 mol·L-1
D. 如果气体 F 能使湿润的蓝色石蕊试纸变红,说明溶液中一定含有 NH4+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com