
科目: 来源: 题型:
【题目】MnSO4晶体是一种易溶于水的微红色晶体,某校同学设计实验制备并检验MnSO4的性质。回答下列问题:
(1)甲组同学设计用SO2和适量纯净的MnO2制备MnSO4,其装置如下:
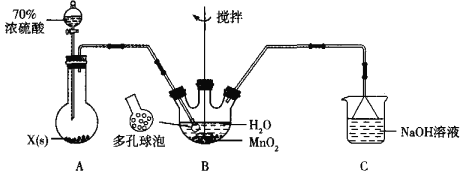
①A装置中固体药品X通常是______填化学式)。
②B装置中通SO2的导管末端接多孔球泡的目的是______;C装置用于吸收少量的SO2,发生反应的离子方程式为______。
(2)乙组同学定性检验甲组同学的产品中Mn2+的存在,取少量晶体溶于水,加入(NH4)2S2O8溶液,滴入硝酸银(作催化剂),微热振荡,溶液显紫色,发生反应的离子方程式为______。
(3)丙组同学为检验无水MnSO4(接近白色)的热分解产物,将MnSO4晶体脱水后放入下图所示的装置中,打开K1和K2,缓慢通入N2,加热,硬质玻璃管中最后得到黑色固体。
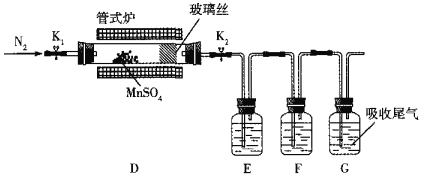
①检验分解的气态产物中是否有SO2及SO3,装置E、F中的溶液依次是______、______(填字母)。
a.Ba(NO3)2溶液b.BaCl2溶液c.品红溶液d.浓硫酸
②若D中得到的黑色粉末为Mn3O4,E、F中均有明显现象,则D中发生反应的化学方程式为______。
(4)丁组同学设计实验以丙组同学得到的黑色粉末为原料,利用铝热反应原理将其还原为金属锰,所需的药品除氯酸钾外,还需要______。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关装置图的叙述正确的是
A. 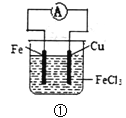 装置①中的总反应为:Cu+2Fe3+=Cu2++2Fe2+
装置①中的总反应为:Cu+2Fe3+=Cu2++2Fe2+
B. 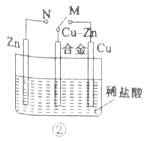 装置②中的开关由M改置于N时,Cu-Zn合金的腐蚀速度增大
装置②中的开关由M改置于N时,Cu-Zn合金的腐蚀速度增大
C.  装置③中在Fe电极区无蓝色沉淀,该方法叫牺牲阳极的阴极保护法
装置③中在Fe电极区无蓝色沉淀,该方法叫牺牲阳极的阴极保护法
D. 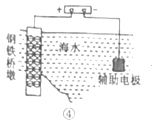 装置④中桥墩与外加电源正极连接能确保桥墩不被腐蚀
装置④中桥墩与外加电源正极连接能确保桥墩不被腐蚀
查看答案和解析>>
科目: 来源: 题型:
【题目】铅蓄电池是典型的可充型电池,起反应为Pb+PbO2+4H++2SO42-![]() 2PbSO4+2H2O:,下列说法正确的是
2PbSO4+2H2O:,下列说法正确的是
A. 放电时负极质量减少,正极质量增加,电解质溶液中H2SO4的浓度将变小
B. 放电时负极的电极反应为:PbO2+2e-+4H++SO42-=PbSO4+2H2O
C. 充电时Pb与电源正极相连
D. 充电时阳极上pbSO4变为PbO2,发生氧化反应
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于价层电子对互斥模型(VSEPR模型)和杂化轨道理论的叙述中正确的是
A. 凡是中心原子采取sp2杂化的分子,其分子构型都是平面三角形
B. 对于主族元素,中心原子的杂化轨道数等于价层电子对数
C. 杂化轨道可用于形成![]() 键、π键或用于容纳未参与成键的弧电子对
键、π键或用于容纳未参与成键的弧电子对
D. Sp3杂化轨道是由任意的1个s轨道和3个p轨道杂化形成的四个sp3杂化轨道
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各项叙述错误的是
A. 如果硫原子核外电子排布图为![]() ,则违反了泡利原理
,则违反了泡利原理
B. 如果25号Mn元素的基态电子排布式为1s22s22p63s23p63d7,则违反了构造原理
C. 氮原子的核外电子排布图为![]() ,符合洪特规则和泡利原理
,符合洪特规则和泡利原理
D. 泡利原理、洪特规则、构造原理都是对核外电子排布满足能量最低的要求
查看答案和解析>>
科目: 来源: 题型:
【题目】PH3是粮食杀虫处理时常用的熏蒸杀虫剂;水煤气变换时产生的PH3能使催化剂中毒,必须脱除。回答下列问题:
(1)PH3通入NaClO溶液脱除PH3时,氧化产物是一种含氧酸且反应中氧化剂与还原剂的物质的量之比为4:1,则该含氧酸的化学式为______。
(2)已知下列键能数据及P4(白磷)分子结构:
化学键 | P-P | H-H | P-H |
|
键能/(kJmol-1) | 213 | 436 | 322 |
则反应4PH3(g)P4(g)+6H2(g)△H=______kJmol-1;某温度时平衡体系中c(PH3)=0.25molL-1,c(H2)=c(P4)=0.50molL-1,则平衡常数K=______。
(3)文献报道“反应6.25CO2(g)+Fe3O4(s)+3PH3(g)=3FePO4(s)+4.5H2O(g)+6.25C(s)”是铁触媒中毒的主导反应,其平衡常数Kp(Kp为以分压表示的平衡常数)的对数值与温度的关系如图所示:
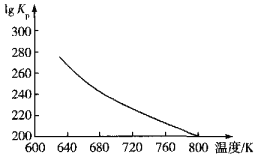
①该反应的△H______0(填“>”“<”或“=”)。
②图中lgKp=______[列出用分压p(CO2)、p(PH3)、p(H2O)表示的计算式]。
(4)反应(CH3)3AuPH3→(CH3)AuPH3+C2H6的历程如下:
第一步:(CH3)3AuPH3![]() (CH3)3Au+PH3(快反应)
(CH3)3Au+PH3(快反应)
第二步:(CH3)3Au![]() C2H6+CH3Au(慢反应)
C2H6+CH3Au(慢反应)
第三步:CH3Au+PH3![]() (CH3)AuPH3(快反应)
(CH3)AuPH3(快反应)
①反应的中间产物有PH3、______。
②第______步(填“一”“二”或“三”)反应的活化能最大。
(5)用Cu2+、Pd2+液相脱除PH3的反应为:PH3+2O2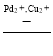 H3PO4,其他条件相同时溶解在溶液中O2的体积分数、PH3的净化效率与时间的关系如图所示:
H3PO4,其他条件相同时溶解在溶液中O2的体积分数、PH3的净化效率与时间的关系如图所示:
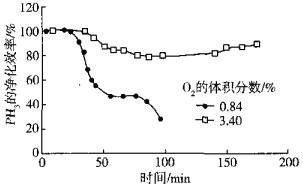
O2的体积分数大,PH3的净化效率高的原因是______(用碰撞理论等说明)。
查看答案和解析>>
科目: 来源: 题型:
【题目】NF3(三氟化氮)在常温常压下是无色、无味的气体,是微电子工业中一种优良的等离子蚀刻气体。回答下列问题:
(1)NF3的电子式为______,N元素的化合价为______。
(2)F2与NH3直接反应生成NF3的化学方程式为______。
(3)实验室模拟工业上利用电解熔融NH4HF2(NH4FHF)法制取NF3,阳极为以Ni为基本材料的合金(内含其他金属,忽略镍及其他金属的反应),阴极为碳素钢,电解废液可回收再利用。
①电解时NF3在______极生成;阴极产生的气体是______(填化学式)。
②电解后废液(含Ni少量Fe和Cu的单质及NH4HF2等)可经如下流程进行回收再利用:
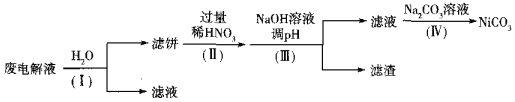
已知该实验条件下,部分金属离子开始沉淀与沉淀完全的pH如下表
金属离子 | Ni2+ | Fe2+ | Cu2+ | Fe3+ |
开始沉淀时的pH | 7.2 | 7.0 | 4.7 | 1.9 |
沉淀完全时的pH | 9.2 | 9.0 | 6.7 | 3.2 |
步骤I的目的是______;步骤Ⅱ滤饼中Ni溶于硝酸的离子方程式为______(HNO3的还原产物为NO);步骤Ⅲ调节pH时,理论上pH应控制的范围是______。
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA表示阿伏伽德罗常数,下列说法正确的是
A. 1molCS2分子中含有1NA个π键
B. 31g白磷(P4)分子中所含的共价键数目为1NA
C. 电解精炼铜时,若阳极质量减少64g,则阴极转移的电子数目一定为2NA
D. 在1mol[Cu(H2O)4]2+中含有12NA个![]() 键
键
查看答案和解析>>
科目: 来源: 题型:
【题目】为了测定铁铜合金的组成,将15.2 g铁铜合金加入200 mL某浓度的稀硝酸中,待合金完全溶解,共生成NO气体4.48 L(标准状况下),并测得溶液中H+的物质的量浓度为0.5 mol·L-1,若反应前后溶液的体积变化忽略不计
(1)n(Fe)=_________n(Cu)=_________
(2)硝酸的物质的量浓度为______________
查看答案和解析>>
科目: 来源: 题型:
【题目】硫和氮及其化合物在生产生活中应用广泛。请回答:
(1)已知反应:3NO2+H2O=2HNO3+NO,该反应中的氧化剂与还原剂的质量比为_____。
(2)工业上可以通过氮气和氢气在一定条件下合成氨气。下列关于氨气的性质和用途描述正确的是____________。
A. 氨气易液化,液氨可作制冷剂 B. 可用排水法收集氨气
C. 氨气是一种无色无味的气体 D. 向氨水中滴加酚酞,溶液变红
(3)1754年,Briestly用硵砂(主要成份NH4Cl)和熟石灰共热制得了氨,化学反应方程式为______________________________。
(4)实验室用金属铜和稀硝酸制取NO的离子方程式为_____________。
(5)汽车尾气常含有NO、NO2、CO等,会污染空气。在汽车尾气排放管处安装一个催化转化器,可使尾气中有害气体CO和NO反应转化为两种无毒气体,该反应的化学方程式为__________________________。
(6)19.2 g铜投入100 mL 14 mol/L浓HNO3溶液中,充分反应后无固体剩余,收集到标准状况下气体8.96 L(气体为NO、NO2),向反应后的溶液中加入______mL 10 mol/L NaOH溶液才能使Cu2+完全沉淀。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com