
科目: 来源: 题型:
【题目】A、B、C、D四物质有如下转化关系(反应条件和部分产物已略去):A![]() B
B![]() C
C![]() D。回答下列问题:
D。回答下列问题:
(1)若A为气态氢化物和D能通过化合反应生成一种盐,则:
①简述检验A气体的方法_________________________________________;
②写出D制备B的离子方程式_________________________________________;
③写出由A生成B的化学方程式_________________________________________;
④某同学用干燥的圆底烧瓶收集一瓶A气体,用滴入酚酞的水做喷泉实验,能观察到美丽的红色喷泉。用方程式解释喷泉呈红色的原因______________________________;
(2)若A与B反应能生成一种淡黄色固体单质。写出B→C的化学方程式_____________;
(3)若A是金属单质,C是一种淡黄色固体。写出C的电子式________说出C的一种用途_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】A(C2H4)是基本的有机化工原料。用A和常见的有机物可合成一种醚类香料和一种缩醛类香料。具体合成路线如图所示(部分反应条件略去):
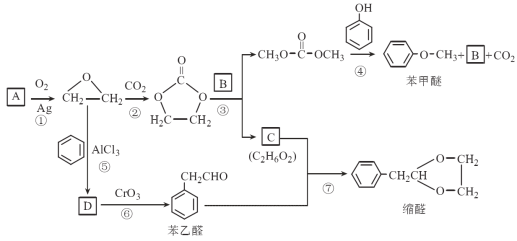
已知以下信息:
①![]()
②D为单取代芳香族化合物且能与金属钠反应;每个D分子中只含有1个氧原子,D中氧元素的质量分数约为13.1%。
回答下列问题:
(1)A的名称是______,图中苯甲醚的分子式是________。
(2)B的结构简式为____________________,D中含有的官能团名称是________。
(3)②的反应类型是____________________。
(4)⑦的化学方程式为__________________________________________________。
(5)请写出满足下列条件的苯乙醛的所有同分异构体的结构简式:含有苯环和![]() 结构,核磁共振氢谱有4组峰,峰面积之比为3∶2∶2∶1。____________
结构,核磁共振氢谱有4组峰,峰面积之比为3∶2∶2∶1。____________
(6)参照 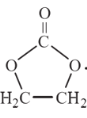 的合成路线,设计一条由2-氯丙烷和必要的无机试剂制备
的合成路线,设计一条由2-氯丙烷和必要的无机试剂制备  的合成路线____________(注明必要的反应条件)。合成路线流程图示例如下:CH3CH2OH
的合成路线____________(注明必要的反应条件)。合成路线流程图示例如下:CH3CH2OH![]() CH2=CH2
CH2=CH2![]() BrCH2-CH2Br
BrCH2-CH2Br
查看答案和解析>>
科目: 来源: 题型:
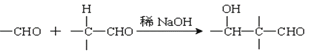
【题目】以乙炔为原料通过以下流程能合成有机物中间体D。

已知:(1)
(2):
请回答下列问题:
(1)化合物A的分子式为___________,1mol A完全燃烧需要消耗_____mol氧气。
(2)反应②的反应类型是:______________;化合物B的名称是:____________。
(3)写出①反应的化学方程式_________________________________________________。
(4)已知1mol HCHO和1mol CH3CH2CHO发生类似已知(2)的反应,生成1molE。写出E的结构简式为:_____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】为测定含镁3%~5%的铝镁合金中镁的质量分数,设计了2种实验方案,说法不正确的是
方案一:镁铝合金加入足量的氢氧化钠溶液中充分反应后过滤,测定剩余固体质量;
方案二:称量m g铝镁合金粉末,放在图中惰性电热板上,通电使其充分灼烧。测得固体质量增重。

A. 方案一中若称取5.4 g合金粉末样品,投入V mL 2.0 mol/L NaOH溶液中反应,则V≥100 mL
B. 方案一中测定剩余固体质量时,过滤后未洗涤固体就干燥、称量,则镁的质量分数偏高
C. 方案二中欲计算镁的质量分数,实验中还需测定灼烧后固体的质量
D. 方案二中若用空气代替O2进行实验,则测定结果偏高
查看答案和解析>>
科目: 来源: 题型:
【题目】已知在温度低于570°C时,还原铁粉与水蒸气反应的产物是FeO;高于570°C时,生成Fe3O4。老师用如图所示实验装置,完成了还原铁粉与水蒸气反应的演示实验。

甲同学为探究实验后试管内固体的成分,进行了下列实验:

试回答下列问题:
(1)湿棉花的作用是_______________________________________________________ 。
(2)写出高于570°C时,Fe与水蒸气反应的化学方程式:______________________________________。
(3)乙同学认为加入KSCN溶液没有出现血红色原因可能是固体中没有Fe3O4,也有可能是因为______(填物质名称)过量造成的。该物质过量时,溶液中还会发生反应,导致加入KSCN溶液时没有出现血红色,该反应的离子方程式是___________________________________________________。
(4)丙同学利用上述实验①加盐酸后的溶液制取白色的Fe(OH)2沉淀,向滤液中加入足量NaOH溶液后,观察到的实验现象为_____________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】NA表示阿伏加德罗常数的数值,下列说法正确的是
A. 在标准状况下,11.2L HF含有的分子数目为0.5NA
B. 高温下,16.8 g Fe与足量水蒸气完全反应失去0.8NA个电子
C. 常温下,0.2 L 0.5 mol·L-1 NH4NO3溶液中含有的氮原子数小于0.2NA
D. 18g葡萄糖(C6H12O6)分子含有的羟基数目为0.6NA
查看答案和解析>>
科目: 来源: 题型:
【题目】用图所示实验装置可以完成中学化学实验中的一些实验。
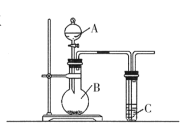
(1)现有稀硝酸、稀盐酸、稀硫酸、碳酸钠粉末、硅酸钠溶液五种试剂。选择三种试剂利用如图装置证明酸性强弱:H2SO4 > H2CO3 > H2SiO3
①仪器B的名称________,A中试剂________,B中试剂________
②C中发生反应的化学方程式:________________________________
(2)利用如图装置实验,证明二氧化硫气体具有漂白性。已知:Na2SO3 + H2SO4=Na2SO4 +SO2↑+H2O。 在装置A中加入 70%的硫酸溶液,B中加入Na2SO3粉末,
①C中应加入________溶液(填“品红”或“石蕊”)。打开分液漏斗活塞,一段时间后观察到C中现象是________________________________,反应完全后,将C试管加热一 段时间发生的现象是________________________
②如果仅用如图装置进行此实验,可能造成环境污染,此污染属于________(选填“白色污染”或“酸雨污染"),因此应该在C装置后加一个盛有________溶液的洗气瓶。
③将二氧化硫气体通入FeCl3溶液中反应一.段时间后,滴加KSCN溶液,溶液未变红色,请写出所发生反应的离子方程式:________________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】元素周期表是学习物质结构和性质的重要工具,下面是元素周期表的一部分,表中所列字母A、D、E、G、Q、M、R分别代表某一化学元素。请用所给元素回答下列问题。

(1)表中某元素原子的核外电子层数是最外层电子数的3倍,该元素的原子结构示意图为_____________。R原子的最外层电子排布式____________________________;原子核外有________种能量不同的电子。R原子最外层有________种运动状态不同的电子。
(2)元素Fe在元素周期表中的位置是__________________________________________。图2中,55.85表示__________________________________________________________。
(3)表中某些元素的原子可形成与Ar具有相同电子层结构的简单离子,这些离子的半径由大到小的顺序是____________________(填离子符号)。
(4)M、D两种元素形成的化合物含有的化学键类型是____________________(填“极性键”或“非极性键”),其分子是____________________(填“极性分子”或“非极性分子”)。D、Q的最高价氧化物形成的晶体相比,熔点较高的是____________________(用化学式表示)。
(5)表中金属性最强的元素与铝元素相比较,可作为判断金属性强弱依据的是________(选填编号)。
a.能否置换出铝盐溶液中铝
b.![]() 能否溶解在该元素最高价氧化物对应水化物中
能否溶解在该元素最高价氧化物对应水化物中
c.单质与氢气化合的难易程度
d.单质与同浓度的稀盐酸发生反应的剧烈程度
(6)在![]() 溶液中逐滴加入G的最高价氧化物的水化物,现象是先产生白色沉淀,然后白色沉淀逐渐消失。请用以上某化学方程式证明Al与G金属性的强弱。______________________。O的非金属性比N强,请用元素周期律的知识分析原因。___________________。
溶液中逐滴加入G的最高价氧化物的水化物,现象是先产生白色沉淀,然后白色沉淀逐渐消失。请用以上某化学方程式证明Al与G金属性的强弱。______________________。O的非金属性比N强,请用元素周期律的知识分析原因。___________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室制备1,2-二溴乙烷的实验流程如下:
![]()
已知:①主要副反应:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚。
②有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
溶解性 | 易溶于水 | 难溶于水 | 难溶于水 |
沸点/℃ | 78.5 | 132 | 34.6 |
试回答下列问题:
(1)乙醇与浓硫酸l70℃发生反应的化学方程式:______________________。
(2)乙醇与浓硫酸反应装置中放入几片碎瓷片,目的是_________________________。
(3)反应得到的混合气体中含有SO2、CO2等气体,检验其中的SO2气体可选用的试剂是_______________________________。
(4)吸收步骤中,应适当降低吸收液的温度,其主要目的是______________。
(5)实验制得的1,2-二溴乙烷粗产品中含有少量未反应的Br2和少量副产品乙醚,某同学进一步提纯如下:
序号 | 实验方案 | 实验目的或结论 |
① | 除去粗产品中少量未反应的Br2,实验方法是_________________ | 除去溴杂质 |
② | 除去粗产品中的乙醚的实验方法是将①实验后的有机混合物进行________________________ | 除去乙醚杂质 |
查看答案和解析>>
科目: 来源: 题型:
【题目】I.将如图装置放置在光亮的地方,随后观察到如下实验现象:大试管内壁上有油状液滴生成、饱和食盐水中有少量固体析出、黄绿色气体颜色变浅、试管内液面有所上升。
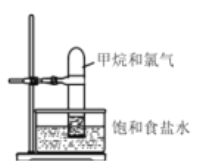
(1)油状液滴中属于非极性分子的电子式为________。
(2)水槽中盛放饱和食盐水而不是蒸馏水是为了抑制________与水的反应。试管内液面上升的原因是________极易溶于水。
II.乙烯是一种重要的化工原料,以乙烯为原料生产部分化工产品的反应如下(部分反应条件已略去):
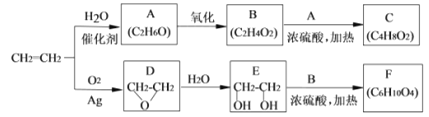
请回答下列问题:
(3)A的名称是________,含有的官能团名称是________。实验室A转化为乙烯的反应条件为________。
(4)B和A反应生成C的化学方程式为________,该反应的类型为________。
(5)F的结构简式为______________。
(6)写出D的同分异构体的结构简式__________________。
(7)乙炔也是常见的一种化工原料,它可以制取很多化工产品,例如:聚氯乙烯塑料。写出乙炔合成聚氯乙烯的合成路线。(合成路线常用的表示方式为:A![]() B
B![]() ……目标产物)______________
……目标产物)______________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com