
科目: 来源: 题型:
【题目】有机物A是一种重要的工业原料,其结构简式如图:
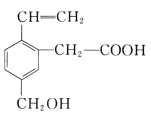
试回答下列问题:
(1)有机物A的分子式为 ;
(2)有机物A中含有的含氧官能团名称是 ;
(3)0.5 mol 该物质与足量金属钠反应,能生成标准状况下的氢气 L;
(4)该物质能发生的反应有 (填序号)。
①能与NaOH溶液反应
②能与溴的四氯化碳溶液反应
③能与甲醇发生酯化反应
④可以燃烧
⑤能发生水解反应
查看答案和解析>>
科目: 来源: 题型:
【题目】某反应在体积为5L的恒容密闭的绝热容器中进行,各物质的量随时间的变化情况如下图所示(已知A、B、C均为气体)。

(1)该反应的化学方程式为_______。
(2)反应开始至2分钟时,B的平均反应速率为_______。
(3)能说明该反应已达到平衡状态的是_______
A.υ(A)=2υ(B) B.容器内气体密度不变
C.v逆(A)=υ正(C) D.各组分的物质的量相等
E. 混合气体的平均相对分子质量不再改变的状态
(4)由图求得平衡时A的转化率为_______。
(5)为了研究硫酸铜的量对氢气生成速率的影响,某同学设计了如下一系列的实验:将表中所给的混合溶液分别加入到6个盛有过量Zn粒的容器中,收集产生的气体,记录获得相同体积的气体所需时间。
实验 混合溶液 | A | B | C | D | E | F |
4 mol/L H2SO4(mL) | 30 | V1 | V2 | V3 | V4 | V5 |
饱和CuSO4溶液(mL) | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
H2O(mL) | V7 | V8 | V9 | V10 | 10 | 0 |
①请完成此实验设计,其中:V1=_______,V6=_______。
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,在密闭容器里进行如下可逆反应:![]() 橙黄色液体
橙黄色液体![]() 气
气![]() 鲜红色液体
鲜红色液体![]() 。下列说法正确的是
。下列说法正确的是![]()
![]()
A. 达到平衡时,单位时间里消耗nmol![]() 的同时也生成n
的同时也生成n![]()
B. 增大压强,平衡常数将增大
C. 达到平衡时,若升高温度,氯气的百分含量减小
D. 加入氯气,平衡向正反应方向移动,氯气的转化率一定升高
查看答案和解析>>
科目: 来源: 题型:
【题目】下表列出了a~m 13种元素在周期表(已省略了过渡元素)中的位置:
族 周期 | ⅠA | 0 | ||||||
1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | a | |
2 | b | c | d | |||||
3 | e | f | g | h | i | |||
4 | j | k | l | |||||
5 | m |
(1)元素b为________(填名称);画出g的原子结构示意图__________。
(2)元素f、i、j的原子半径从大到小的顺序是____________(用元素符号表示);这三种原子分别形成简单离子后,离子半径从大到小的顺序是_____________(用离子符号表示)。
(3)h和k的原子序数相差___________(填数字)。
(4)元素d和e形成的一种化合物为淡黄色固体,该化合物的电子式为___________,该化合物中化学键有____________,该化合物与c的最高价氧化物反应的化学方程式为_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】我国科学家发明的一种可控锂水电池的工作原理如图所示。下列有关说法不正确的是( )

A.电池工作时,锂离子向正极移动B.电池总反应为![]()
C.有机电解质可用水溶液代替D.该装置不仅可提供电能,还可得到清洁的氢气
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述及解释正确的是
A. 2NO2(g)(红棕色)![]() N2O4(g)(无色) ΔH<0,在平衡后,对平衡体系采取缩小容积、增大压强的措施,因为平衡向正反应方向移动,故体系颜色变浅
N2O4(g)(无色) ΔH<0,在平衡后,对平衡体系采取缩小容积、增大压强的措施,因为平衡向正反应方向移动,故体系颜色变浅
B. 对于C(s) + O2(g) ![]() 2CO(g) ,在平衡后,加入碳,平衡向正反应方向移动
2CO(g) ,在平衡后,加入碳,平衡向正反应方向移动
C. FeCl3+3KSCN![]() Fe(SCN)3(红色)+3KCl,在平衡后,加少量KCl,因为平衡向逆反应方向移动,故体系颜色变浅
Fe(SCN)3(红色)+3KCl,在平衡后,加少量KCl,因为平衡向逆反应方向移动,故体系颜色变浅
D. 对于N2+3H2![]() 2NH3,平衡后,压强不变,充入O2,平衡向逆方向移动
2NH3,平衡后,压强不变,充入O2,平衡向逆方向移动
查看答案和解析>>
科目: 来源: 题型:
【题目】![]() 是一种饲料营养强化剂。一种利用水钴矿(主要成分为
是一种饲料营养强化剂。一种利用水钴矿(主要成分为![]() 、
、![]() ,还含少量
,还含少量![]() 、
、![]() 、MnO等),制取
、MnO等),制取![]() 的工艺流程如图1:
的工艺流程如图1:
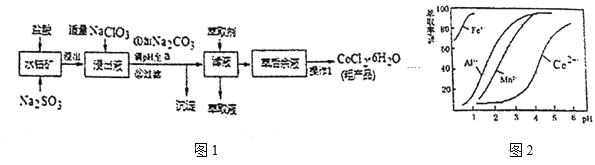
已知:①浸出液含有的阳离子主要有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 等;
等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:(金属离子浓度为:0.01mol/L)
③![]() 熔点为86℃,加热至110~120℃时,失去结晶水生成无水氧化钴。
熔点为86℃,加热至110~120℃时,失去结晶水生成无水氧化钴。
沉淀物 |
|
|
|
|
|
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)写出浸出过程中![]() 发生反应的离子方程式____。
发生反应的离子方程式____。
(2)写出NaClO3发生反应的主要离子方程式____,若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式____。
(3)“加![]() 调pH至a”,过滤所得到的沉淀成分为___。
调pH至a”,过滤所得到的沉淀成分为___。
(4)制得的![]() 在烘干时需减压烘干的源因是___。
在烘干时需减压烘干的源因是___。
(5)萃取剂对金属高子的萃取率与pH的关系如图2。向“滤液”中加入萃取剂的目的是___﹔其使用的最佳pH范围是___。
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5
查看答案和解析>>
科目: 来源: 题型:
【题目】如表所示为元素周期表的一部分,参照元素①~⑩在表中的位置,请回答下列问题:

(1)写出①和④两种元素原子按1:1组成的常见化合物的电子式______。
(2)用电子式表示⑥和⑨形成化合物的过程:______。
(3)③、⑧、⑩的最高价氧化物对应水化物的酸性由强到弱的顺序为 ______(用化学式表示)。
(4)已知周期表中存在对角相似规则,如②与⑦在周期表中处于对角线位置则化学性质相似,②的氧化物、氢氧化物也有两性,写出②的氢氧化物与⑥的氢氧化物反应的化学方程式 ______。
(5)⑤、⑥、⑩的离子半径由大到小的顺序为 ______(用离子符号表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】![]() 是制备活性ZnO的中间体,以锌焙砂(主要成分为ZnO,含少量
是制备活性ZnO的中间体,以锌焙砂(主要成分为ZnO,含少量![]() 、
、![]() 等离子)为原料制备
等离子)为原料制备![]() 的工艺流程如图,下列说法不正确的是
的工艺流程如图,下列说法不正确的是

A.当![]() ,
,![]() 的混合溶液呈中性时,
的混合溶液呈中性时,![]()
B.“浸取”时为了提高锌的浸出率,可采取的措施是搅拌、适当加热
C.“浸取”时加入的![]() 过量,生成
过量,生成![]() 的离子方程式为:
的离子方程式为:![]()
D.“过滤Ⅲ”所得滤液可循环使用,其主要成分的化学式是![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】纳米Fe3O4晶体材料可以作为核磁共振造影增强剂,用于疾病的诊断和治疗,其制备过程如图所示,下列叙述不合理的是
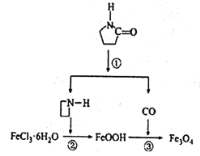
A. 在反应②中,![]() 的作用可能是促进氯化铁水解
的作用可能是促进氯化铁水解
B. 直接加热FeCl3溶液也可以得到Fe3O4
C. 反应③的化学方程式是6FeOOH+CO=2Fe3O4+3H2O+CO2
D. 纳米四氧化三铁形成的分散系,有可能产生丁达尔效应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com