
科目: 来源: 题型:
【题目】下表是元素周期表的一部分,除标出的元素外,表中的每个编号表示一种元素,请根据要求回答下列问题。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
2 | ① | ② | |||||
3 | ③ | ④ | ⑤ | ⑥ |
(1)①和②两种元素的非金属性强弱关系是:①________②(填“>”或“<”)。
(2)③和⑥两种元素形成的化合物中含有的化学键为__________(填“离子键”或“共价键”) 。
(3)元素②和⑤组成的化合物属于_________(填“酸性”“碱性”或“两性”)氧化物。
(4)工业上冶炼元素④所形成的单质,其相关反应的化学方程式为_________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C是中学化学常见的三种物质,它们之间的相互转化关系如下所示(部分反应条件及产物略去):
![]()
![]()
![]()
![]()
![]()
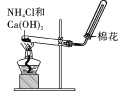
(1)若A是一种淡黄色固体单质,则C与H2O反应的生成物为______(填化学式)。
(2)若C是一种淡黄色固体化合物,则C与CO2反应的化学方程式______________________________。
(3)若A可由图所示装置制得,且B、C均为会污染空气的气体,请写出A转化成B的化学方程式:________________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系:![]() 。下列有关物质的推断不正确的是
。下列有关物质的推断不正确的是
A. 若甲为Cl2,则丁可能是铁B. 若甲为NH3,则丁可能是氧气
C. 若甲为AlCl3溶液,则丁可能是氨水D. 若甲为NaOH,则丁可能是SO2
查看答案和解析>>
科目: 来源: 题型:
【题目】根据题意解答
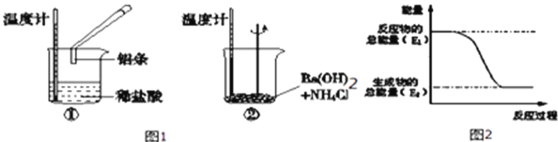
(1)某实验小组同学进行如下实验,以检验化学反应中的能量变化,据实验现象判断①是_________热反应,②是_________热反应.反应过程___(填“①”或“②”)的能量变化可用图2表示.
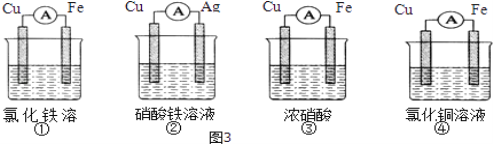
(2)为了验证Fe3+与Cu2+氧化性强弱,下列装置能达到实验目的是_________(填序号).
(3)将H2设计成燃料电池,其利用率更高,装置如图4所示(a、b为多孔碳棒),负极通入_______其电极反应式为________________电池总反应为______________
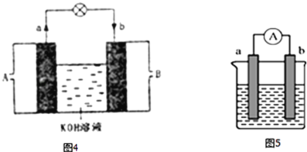

(4)如图5是某化学兴趣小组探究不同条件下化学能转变为电能的装置.
①若两个电极分别是锌、铜,电解质溶液是稀硫酸,正极的电极反应式___________;若电极保持不变,将电解质溶液换成硫酸铜,请将该电池设计为双液原电池画入图6中___________;
②当电极a为Al、电极b为Mg、电解质溶液为氢氧化钠时,该原电池的负极为_______;该原电池的电池总反应为_____________________________.
③若电池的总反应是2FeCl3+Fe![]() 3FeCl2,则可以作正极材料的是________,正极反应式是__________若该电池反应消耗了0.1mol FeCl3,则转移电子的数目为_____。
3FeCl2,则可以作正极材料的是________,正极反应式是__________若该电池反应消耗了0.1mol FeCl3,则转移电子的数目为_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上用铝土矿(主要成分是Al2O3,还有少量的Fe2O3、SiO2)提取冶炼铝的原料氧化铝。工艺流程如图,下列有关说法正确的是

A.该流程中,原料A可以是盐酸,也可以是氢氧化钠溶液
B.步骤2 中要发生的反应有:Fe3++3OH-=Fe(OH)3↓、Al3++4OH-=[Al(OH)4] -、H++OH-=H2O
C.滤液3中的主要离子有碳酸根、钠离子、氯离子
D.工业上冶炼铝用氧化铝不用氯化铝的原因是,氧化铝是电解质,氯化铝是非电解质
查看答案和解析>>
科目: 来源: 题型:
【题目】乙烯、乙酸、乙醇是重要的有机化合物。请根据题意填空:
(1)在工业上,可以用________(填名称)的产量来衡量一个国家的石油化工发展水平。
(2)乙酸的官能团的名称为____________________。
(3)请写出乙酸与乙醇发生酯化反应的化学方程式:__________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某原电池装置示意图如图所示。下列有关该原电池的说法正确的是

A. 锌片是正极
B. 溶液中H+由铜电极移向锌电极
C. 铜片上有气泡产生
D. 电子由铜电极经导线流向锌电极
查看答案和解析>>
科目: 来源: 题型:
【题目】探究Cu和浓硫酸的反应,下列装置或操作正确的是

A. 用装置甲、乙制备SO2和收集SO2
B. 用装置甲、丙制备SO2和稀释CuSO4溶液
C. 用装置乙、丁收集SO2和检验SO2的漂白性
D. 用装置甲、丁制备SO2和探究SO2的漂白性
查看答案和解析>>
科目: 来源: 题型:
【题目】某有机物,只可能含有C、H、O三种元素,在标况下,其蒸气的密度是H2的21倍。测得其质量为10.5g,在氧气中充分燃烧,生成33g二氧化碳和13.5g水,求该化合物的分子式,并写出其所有可能结构简式。
查看答案和解析>>
科目: 来源: 题型:
【题目】为探究实验室制乙烯及乙烯和溴水的加成反应。甲同学设计了如图所示的实验装置,并进行了实验。当温度升至170℃左右时,有大量气体产生,产生的气体通入溴水中,溴水的颜色迅速褪去。甲同学认为达到了实验目的。
乙同学仔细考察了甲同学的整个实验过程,发现当温度升到100℃左 右时,无色液体开始变色,到160℃左右时,混合液全呈黑色,在170℃超过后生成气体速度明显加快,生成的气体有刺激性气味。由此他推出,产生的气体中应有杂质,可能影响乙烯的检出,必须除去。据此回答下列问题:

(1)写出甲同学实验中两个反应的化学方程式:_____________、___________________________。
(2)乙同学观察到的黑色物质是_____________,刺激性气体是_____________。乙同学认为刺激性气体的存在就不能认为溴水褪色是乙烯的加成反应造成的。原因是(用化学方程表示):________。
(3)丙同学根据甲乙同学的分析,认为还可能有CO、CO2两种气体产生。为证明CO存在,他设计了如下过程(该过程可把实验中产生的有机产物除净):发现最后气体经点燃是蓝色火焰,确认有一氧化碳。

①设计装置a的作用是____________________
②浓溴水的作用是_______________________,稀溴水的作用是____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com