
科目: 来源: 题型:
【题目】原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献。
(1)将纯锌片和纯铜片按图方式插入100 mL相同浓度的稀硫酸中一段时间,回答下列问题:
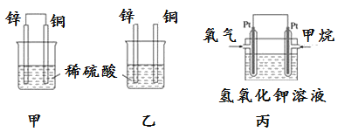
①下列说法正确的是____________。
A.甲、乙均为化学能转变为电能的装置 B.乙中铜片上没有明显变化
C.甲中铜片质量减少、乙中锌片质量减少 D.甲乙两烧杯中溶液的 pH 均增大
②同条件下两烧杯中产生同体积的气体,需要的时间甲________乙(填“>”“<”或“=”)。
③请写出甲乙图中构成原电池的负极电极反应式:__________________。
④当甲中溶液质量增重15.75g时,电极上转移电子数目为______________。
(2) 图丙为甲烷氧气燃料电池的构造示意图,电解质溶液的溶质是KOH。写出负极的电极反应方程式为____________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下表所列各组物质中,能一步实现如图所示各步转化关系的是( )
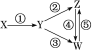
选项 | X | Y | Z | W |
A | Fe3O4 | Fe | FeCl2 | FeCl3 |
B | Al | Al2O3 | NaAlO2 | Al(OH)3 |
C | NH3 | NO | NO2 | HNO3 |
D | Si | SiO2 | H2SiO3 | Na2SiO3 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】电离平衡常数是衡量弱电解质电离程度强弱的量。已知如表数据。
化学式 | 电离平衡常数(25℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
(1)25 ℃时,有等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液,三种溶液的pH由大到小的顺序为__________________。
(2)25 ℃时,pH=3的CH3COOH溶液和pH=11的NaOH溶液混合,若所得溶液显酸性,则c(Na+)__________c(CH3COO-)(填“>”、“<”或“=”)。
(3)NaCN溶液中通入少量CO2,所发生反应的化学方程式为___________。
(4)25 ℃时, pH=8的CH3COONa溶液中,c(Na+)-c(CH3COO-)=___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,在 2 L 恒容密闭容器中 3 种物质间进行反应,X、Y、Z 的物质的量随时间的变化曲线如图所示,反应在 t1 min 时达到平衡。
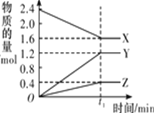
(1)请写出该反应的化学方程式:____________________________
(2)若上述反应中X、Y、Z 分别为NH3、H2、N2的一种,在此t1 min 时间内,用H2 表示该反应的平均速率υ(H2)为____________________________
(3)拆开 1mol 共价键所需吸收的能量如下表:
共价键 | H-H | N≡N | N-H |
吸收的能量/kJ | 436 | 946 | 391 |
1mol N2 完全反应生成NH3__________(填:吸收或放出多少)kJ 能量。但事实上,将 1molN2 和3molH2放在反应容器中,使它们充分反应,反应的热量变化总小于计算值,原因是________________________________
(4)下列叙述能判断该反应达到平衡状态的是___________(填字母代号)。
A.容器内各气体组分的质量分数不再发生改变
B.容器内气体的压强不再发生改变
C.容器内气体的密度不再发生改变
D.混合气体的平均相对分子质量不再发生改变
查看答案和解析>>
科目: 来源: 题型:
【题目】如图为某加碘盐标签的一部分。

已知:①KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O
②I2+2Na2S2O3=2NaI+Na2S4O6(无色)
某同学想定量测定此加碘盐中碘元素的含量,进行以下实验:
步骤1:称取ag市售食盐,配成溶液,全部转移至锥形瓶中,加入适量新制KI溶液,滴入几滴稀硫酸,溶液变黄色,再加入3滴淀粉溶液。
步骤2:取一支50mL碱式滴定管,用bmol·L-1的新制Na2S2O3 溶液润洗2~3次后,装满溶液,调节液面高度至0刻度。
步骤3:开始滴定直至终点,重复操作2~3次,实验数据记录如下:

(1)第一次读数为 mL。
(2)滴定终点的判断方法 。
(3)经过计算,此碘盐碘元素的含量为 mg·kg-1(用含a、b的最简表达式表示) 。
(4)下列操作可能会导致测量结果偏低的是 。
A.步骤1中称取食盐时将砝码放在左盘,食盐放在放在右盘,游码读数为0.5g
B.步骤1所配食盐溶液未完全转移至锥形瓶
C.步骤2中滴定管洗涤后未润洗
D.步骤3滴定前滴定管尖嘴处有气泡,滴定后气泡消失
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)家用液化石油气的主要成分之一是甲烷,当16 kg甲烷完全燃烧并生成二氧化碳气体和液态水时,放出的热量为8.9×105 kJ。已知1mol液态水汽化时需要吸收44 kJ热量。试写出甲烷燃烧生成水蒸气的热化学方程式: 。
(2)有同学用甲烷与空气为原料制作一燃烧电池,若以稀硫酸为电解质溶液时,其负极反应式为 。
(3)已知拆开1 mol H-H键,1 molN-H键,1 molN≡N键分别需要的能量是akJ、bkJ、ckJ,则N2与H2反应生成NH3的热化学方程式为 。
查看答案和解析>>
科目: 来源: 题型:
【题目】下图所示三个烧瓶中分别装入含酚酞的0.01 mol·L-1 CH3COONa溶液,并分别放置在盛有水的烧杯中,然后向烧杯①中加入生石灰,向烧杯③中加入NH4NO3晶体,烧杯②中不加任何物质。

(1)含酚酞的0.01 mol·L-1 CH3COONa溶液显浅红色的原因为______________(用离子方程式解释)。
(2)实验过程中发现烧瓶①中溶液红色变深,烧瓶③中溶液红色变浅,则下列叙述正确的是_____________(填字母)。
A.水解反应为放热反应 B.水解反应为吸热反应
C.NH4NO3溶于水时放出热量 D.NH4NO3溶于水时吸收热量
(3)向0.01 mol·L-1 CH3COONa溶液中分别加入NaOH固体、Na2CO3固体、FeSO4固体,使CH3COO-水解平衡移动的方向分别为__________、___________、__________。(填“左”、“右”或“不移动”)
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下有0.1 mol·L-1四种溶液NaOH、 NH3·H2O、 HCl 、CH3COOH
(1)已知CH3COOH溶液的pH=3,其电离度为 ,由水电离的c(H+)= mol·L-1。
(2)相同pH的CH3COOH溶液和HCl溶液加水稀释,其pH变化情况如图,其中表示HCl溶液的是曲线 ,a、b两点中,导电能力更强的是 。

(3)NH3·H2O溶液和HCl溶液混合,已知体积V(NH3·H2O)> V(HCl),当溶液中c(NH3·H2O)= c(NH4+)时,溶液的pH= 。[已知:Kb(NH3·H2O)=1.77×10-5,lg 1.77=0.25]
查看答案和解析>>
科目: 来源: 题型:
【题目】0.1000mol/L的盐酸滴定20 mL0.1000mol/L氨水,滴定曲线如下图,下列说法正确的是( )
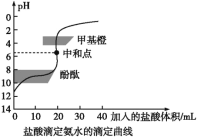
A. 该中和滴定适宜用酚酞作指示剂
B. 两者恰好中和时,溶液的pH=7
C. 达到滴定终点时,溶液中:c(H+)=c(OH-)+c(NH3·H2O)
D. 当滴入盐酸达40 mL时,溶液中c(NH4+)+c(H+)=c(Cl-)
查看答案和解析>>
科目: 来源: 题型:
【题目】中学常见的短周期主族元素R、X、Y、Z、M的原子序数依次增大,它们占据三个周期。Y和M位于同主族,Y原子最外层电子数是电子层数的3倍。这五种元素组成一种离子化合物Q。取一定量Q溶于蒸馏水得到溶液,向溶液中滴加稀氢氧化钠溶液,产生的沉淀质量与滴加氢氧化钠溶液体积的变化情况如图所示。下列说法不正确的是( )
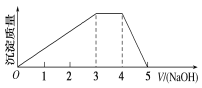
A.简单离子半径:M>Y>Z
B.气态氢化物的热稳定性:Y>X
C.最高价氧化物对应水化物的酸性:M>Z
D.由R、X、Y、M四种元素只能组成二种盐
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com