
科目: 来源: 题型:
【题目】化石燃料是有机物的重要来源,从煤和石油获取的有机物苯和乙烯等简单有机物还是合成其他有机物的原料。如图的转化关系中,已知C能使碳酸钠溶液释放出CO2,反应①②反应机理类似且原子利用率均为 100%,请回答下列问题:

(1)有机物B中含有的官能团名称是_________________。
(2)反应①的反应类型为_________________。
(3)写出反应④的化学方程式__________________________。
(4)下列说法正确的是_________________。
A.乙烯与氧气在催化剂作用下反应也可以生成 C
B.纯C在 16.6℃ 以下呈冰状固体
C.在制备D时,D中常混有一些挥发出来的反应物,可以通过加入NaOH溶液振荡再分液的方法提纯
D.石油裂解气通过净化和分离也能得到丙烯这样的短链烯烃
查看答案和解析>>
科目: 来源: 题型:
【题目】以NaCl为原料可制取下列物质,下列说法正确的是

A.工业上是用阴离子交换膜电解槽作为反应①的发生装置
B.漂白粉久置于空气中变质时既发生非氧化还原反应,也发生氧化还原反应
C.反应③是侯氏制碱法,生产过程中先通入CO2,再通入NH3
D.可以用澄清石灰水检验反应④后所得固体中是否有NaHCO3存在
查看答案和解析>>
科目: 来源: 题型:
【题目】下列电化学装置能达到目的的是

A.图甲:制取少量Fe(OH)2
B.图乙:证明铁发生了析氢腐蚀
C.图丙:在铁表面镀锌
D.图丁:实现原电池反应Cu+2Fe3+=Cu2++2Fe2+
查看答案和解析>>
科目: 来源: 题型:
【题目】固体粉末 X 中可能含有 Fe2O3、CuO、MnO2、CaO、NaCl 和 K2CO3 中的若干种。为确定该固体粉末的成分,进行了以下实验(所加试剂均过量):
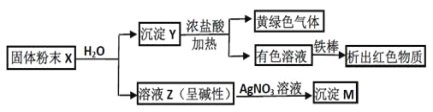
下列结论正确的是:
A. 固体粉末中一定含 K2CO3B. X 中可能存在 Fe2O3
C. 沉淀 M 一定含 AgClD. 沉淀 Y 中不一定存在 MnO2
查看答案和解析>>
科目: 来源: 题型:
【题目】如图表示化学反应过程中的能量变化,据图判断下列说法中合理的是( )

A.铵盐和碱混合即可反应,其能量变化符合图 1
B.0.1mol H2SO4 溶液和 0.1mol Ba(OH)2 溶液的反应符合图 2,且吸收热量为ΔE2
C.0.1mol HCl 溶液和 0.1mol NaOH 溶液的反应符合图 1,且放出热量为ΔE1
D.发生图 1 能量变化的任何反应,一定不需要加热即可发生
查看答案和解析>>
科目: 来源: 题型:
【题目】已知 4NH3+5O2 = 4NO+6H2O(g),若反应速率分别用 v(NH3)、v(O2)、v(NO)、v(H2O)表示,则正确的关系是( )
A.v(O2)=![]() v(NH3)B.v(H2O)=
v(NH3)B.v(H2O)= ![]() v(O2)C.v(H2O)=
v(O2)C.v(H2O)=![]() v(NH3)D.v(NO)=
v(NH3)D.v(NO)= ![]() v(O2)
v(O2)
查看答案和解析>>
科目: 来源: 题型:
【题目】反应NH4Cl+NaNO2![]() NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是
NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是
A. 中子数为18的氯原子:![]()
B. N2的结构式:N=N
C. Na+的结构示意图: 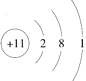
D. H2O的电子式: ![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】一种制备N2H4·H2O(水合肼)和无水Na2SO3的主要实验流程如下:

已知:温度超过40 ℃,Cl2与NaOH溶液反应会生成副产物NaClO3。
⑴“反应Ⅰ”中NaOH应过量且同时减慢通入Cl2的速率,目的是______。
⑵常温时,将Cl2通入NaOH溶液中,一段时间后溶液中将有NaClO3生成,原因是______。
⑶写出“反应Ⅱ”中NaClO与(NH2)2CO反应的化学方程式:______。
⑷“反应Ⅲ”中会有气体______(填化学式)生成,检验有该气体的方法是______。
⑸图所示为Na2SO3的溶解度随温度的变化曲线,由质量分数为10%的Na2SO3溶液制取无水Na2SO3的方法是______。
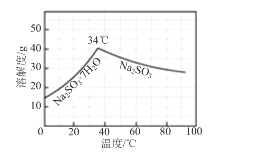
查看答案和解析>>
科目: 来源: 题型:
【题目】(一种由天然MnO2矿与MnS矿(还含Fe、Al、Mg、Zn、Ni、Si等元素的氧化物)制备高纯碳酸锰工艺如下:
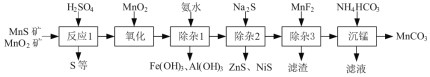
已知:相关金属离子形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
⑴“反应1”中MnO2与MnS反应的化学方程式为______。
⑵“反应1”后所得沉淀物中除S外,一定还含有的氧化物是______(填化学式)。
⑶“除杂2”后溶液中c(Zn2+)=1×105 mol·L1,则溶液中c(Ni2+)=______mol·L1。[已知:Ksp(ZnS)=2×1022,Ksp(NiS)=1×1024]
⑷“滤渣”的成分为______(填化学式);“滤液”中所含溶质的主要成分为___(填化学式)。
⑸将部分MnCO3溶于稀硫酸,所得溶液电解可制得MnO2循环使用。写出电解时所发生反应的离子方程式:______。
查看答案和解析>>
科目: 来源: 题型:
【题目】三氧化二镍是一种重要的电子元件材料、蓄电池材料。工业上利用含镍废料(以镍、铁、钙、镁合金为主)制取草酸镍(NiC2O4·2H2O),再高温煅烧草酸镍制取三氧化二镍。已知草酸的钙、镁、镍盐均难溶于水。根据下列工艺流程示意图回答问题。
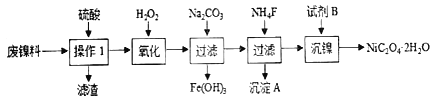
下列说法不正确的是
A. 操作1的名称为过滤,为了加快过滤速度要使用玻璃棒搅拌
B. 加入H2O2的目的是将 Fe2+氧化为 Fe3+
C. 加入NH4F的目的是除去钙离子、镁离子
D. 试剂 B的名称为草酸或可溶性的草酸盐
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com