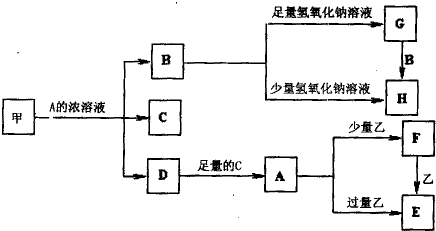
中学化学中常见的几种物质存在如下关系,其中甲是黑色非金属单质,乙是生活中常见的金属单质,D是红棕色气体.(图中部分产物和反应条件已略去)
回答下列问题:
(1)写出甲与A的浓溶液反应的化学方程式
C+4HNO
3(浓)
CO
2↑+4NO
2↑+2H
2O
C+4HNO
3(浓)
CO
2↑+4NO
2↑+2H
2O
.
(2)将等体积等浓度的G溶液和H溶液混合后得到的溶液中的离子浓度大小关系为
c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
.
(3)除去G固体中含有H杂质采用的方法是
加热
加热
.
(4)A溶液与一种能使湿润的红色石蕊试纸变蓝色的气体反应,生成一种盐,该盐的溶液呈酸性,其原因是(用离子方程式表示)
NH
4++H
2O

NH
3?H
2O+H
+NH
4++H
2O

NH
3?H
2O+H
+.
(5)写出向E溶液中加入少量稀硫酸后反应的离子方程式
3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O
3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O
.将溶液F加热蒸干、灼烧到质量不再减少时所得固体物质的化学式为
Fe2O3
Fe2O3
.
(6)确定E中阳离子实验的方法为
先加入KSCN溶液无变化再加入氯水(或盐酸等)溶液变红色
先加入KSCN溶液无变化再加入氯水(或盐酸等)溶液变红色
.

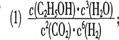

 NH3?H2O+H+
NH3?H2O+H+ NH3?H2O+H+
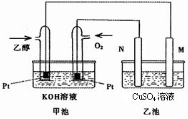
NH3?H2O+H+ 如图为原电池装置示意图:
如图为原电池装置示意图: