
科目: 来源: 题型:
【题目】(一)乙醇是一种重要的化工原料,也常用于生产乙醇汽油,解决燃油替代问题。最新以生物质为原料合成乙醇的方案设计中,化学家提出了用H2还原乙酸的方法来提高乙醇的产率和品质。
(1)用H2还原乙酸获得乙醇的反应为 CH3COOH(g)+2H2(g)![]() CH3CH2OH(g)+H2O(g) ΔH。该反应在一定条件下能自发进行,则ΔH__________(填“<”或“>”)0。
CH3CH2OH(g)+H2O(g) ΔH。该反应在一定条件下能自发进行,则ΔH__________(填“<”或“>”)0。
(2)已知该工艺中存在副反应:CH3COOH(g)+H2(g)![]() CO(g)+CH4(g)+H2O(g) ΔH>0。下列措施不能提高乙醇产率的是_____________。
CO(g)+CH4(g)+H2O(g) ΔH>0。下列措施不能提高乙醇产率的是_____________。
A.升高温度 B.增大压强
C.选择合适催化剂 D.增大![]()
(3)下列描述能说明反应CH3COOH(g)+2H2(g)![]() CH3CH2OH(g)+H2O(g)已达化学平衡的是________。
CH3CH2OH(g)+H2O(g)已达化学平衡的是________。
A.氢气、乙酸、乙醇的浓度相同 B.2v(H2)正=v(CH3CH2OH)逆
C.生成1 mol CH3COOH的同时生成1 mol H2O D.体系中乙醇的百分含量保持不变
(4)在![]() =2的条件下投料,某研究小组进行了在相同压强下在相同时间内乙醇的产率随温度变化的测定实验。在图中画出乙醇的产率随温度变化的示意图__________。
=2的条件下投料,某研究小组进行了在相同压强下在相同时间内乙醇的产率随温度变化的测定实验。在图中画出乙醇的产率随温度变化的示意图__________。

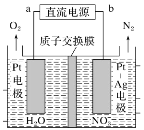
(二)NO2是大气污染的主要污染物之一;硝酸盐是水体污染的污染物之一。电化学降解NO3-的原理如图所示,阴极电极反应式为___________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某包黑色固体混合物可能含有铁粉、氧化铜、炭粉中的二种或三种,取 86.4g 此固体混合物通足量氢气并加热使之反应完全,剩余固体质量 73.6g ,将此剩余固体溶于 1000mL0.500mol·L-1 硫酸中,过滤,向滤液中加入 500mL 某浓度 NaOH 溶液,恰好使沉淀完全,将沉淀灼烧得固体 32.0g。试计算:
(1)所用 NaOH 溶液的浓度是____________mol·L-1。
(2)固体混合物的成分及其物质的量之比是____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】40℃,向体积为VL的密闭容器中充入NO,容器内各组分的物质的量随时间变化曲线如图所示。下列说法正确的是

A.X是N2O
B.1 min~3 min时,v(NO2)=1/6Vmol·(L·min)-1
C.40℃时该反应的平衡常数为1
D.NO2和X的浓度相等可以作为判断反应到达平衡的标志
查看答案和解析>>
科目: 来源: 题型:
【题目】为研究硝酸的性质设计并完成如下实验:
a、某兴趣小组设计如图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化。
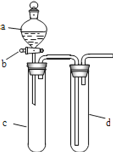
(1)实验前,关闭活塞 b,试管 d 中加水至浸没长导管口,塞紧试管 c 和 d 的胶塞,加热 c,其目的是__________
(2)在 d 中加适量 NaOH 溶液,c 中放一小块铜片,由分液漏斗 a 向 c 中加入2mL 浓硝酸,c 中反应的离子方程式___________________________________________;再由 a 向 c 中加 2mL 蒸馏水、写出 c 中可能进行的两个反应的化学方程式_______________________________________;________________________________________.
b、室温下,将铁片分别置于适量的稀 HNO3 和浓 HNO3 中(如图所示)。

(1)气球的作用是_____________________________________
(2)A中溶液最终变为浅绿色,发生反应的离子方程式是______________________
(3)B 中无明显变化,该同学进一步探究如下:假设①常温下铁与浓硝酸不反应。②_______________________
进行实验:将 B 中的铁片取出并洗净后,放入 CuSO4 溶液中,无明显变化, 则说明假设①_____________(填“成立”或“不成立”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸亚铁铵[(NH4)2Fe(SO4)2]是分析化学中的重要试剂:某学习小组为探究其分解产物设计如下实验装置。

硫酸亚铁铵在500 ℃时隔绝空气加热完全分解,固体产物可能有 FeO和Fe2O3,气体产物可能有NH3、SO3、SO2、N2和H2O
(1)A 中固体充分加热较长时间后,通入氮气,目的是 _______________ 。
(2)能证明气体产物中有SO2 的实验现象是____________
(3)设计一个实验方案,用化学方法证明固体产物不含二价铁:________________
查看答案和解析>>
科目: 来源: 题型:
【题目】利用电解法无害化处理水体中的NO3-,最终生成N2逸出。其装置及转化如图所示。列说法正确的是
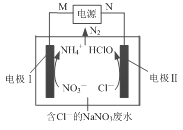
A.N电极为电源的负极
B.电解池工作时Na+移向电极Ⅱ
C.电极Ⅰ的电极反应:NO3-+8e+10H+=NH4++3H2O
D.电解池工作时电极Ⅰ产生的NH4+被电极Ⅱ产生的HClO氧化为N2
查看答案和解析>>
科目: 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A.图1表示镁条与盐酸反应的能量变化
B.图2表示H2SO4溶液中滴入BaCl2溶液后,溶液的导电性随BaCl2物质的量的变化
C.图3表示电解精炼铜时,溶液中Cu2+的物质的量浓度随转移电子物质的量的变化
D.图4表示其他条件一定,反应2SO2+O2![]() 2SO3在有、无催化剂情况下SO2的体积分数随时间的变化
2SO3在有、无催化剂情况下SO2的体积分数随时间的变化
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是几种烷烃的球棍模型,试回答下列问题:
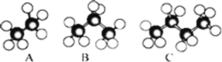
(1) A、B、C 三者的关系是_______________
(2) A 的分子式为_______________,C 的名称为______________
(3)写出C 的同分异构体的结构简式______________
(4) B 是 2008 年北京奥运会火炬燃料的主要成分,若 22g B 气体完全燃烧,生成 CO2 气体和液态水,放出 1108 kJ 热量,则其燃烧的热化学方程式为_____________________________________________________________________________________.
(5)D 为六个碳的烷烃,且其一氯代物只有两种,写出 D 的结构简式_______________
查看答案和解析>>
科目: 来源: 题型:
【题目】某学生为了探究锌与盐酸反应过程中的速率变化,在 100 mL 稀盐酸中加入足量的锌粉,标准状况下测得数据累计值如下:
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
(1)在 0~1、1~2、2~3、3~4、4~5 min 各时间段中:反应速率最大的时间段是_______________; 在 0~5min 内,反应速率变化的原因是______________________________________________________________________________________
(2)在 2~3 min 时间段内,用盐酸的浓度变化表示的反应速率为_______________
(3)为了减缓反应速率但不减少产生气的量,在盐酸中分别加入等体积的下列液体:
A.蒸馏水 B.Na2SO4 溶液 C.NaOH 溶液 D.H2SO4 溶液 E.Na2CO3
你认为可行的是(填编号)_______________。
(4)为了加快锌和盐酸的反应,采用了如图的装置。
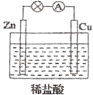
此装置中负极为_______________,写出正极的电极反应式______________;
若收集到标况下 2.24L 气体,转移了电子_______________________mol,溶解了Zn______________g.
查看答案和解析>>
科目: 来源: 题型:
【题目】已知化合物 A 由两种元素组成,某研究小组按如图流程探究其组成,其中 D 是一种能使品红溶液褪色的气体。
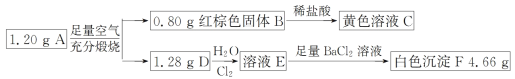
请回答下列问题:
(1)化合物 A 的组成元素有______。(填元素符号)
(2)写出 A→B+D 的化学方程式_________。
(3)写出 D→E 的离子方程式________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com