
科目: 来源: 题型:
【题目】某Na2CO3、NaAlO2的混合溶液中逐滴加入1molL1的盐酸,测得溶液中的CO32、HCO3、AlO2、Al3+的物质的量与加入盐酸溶液的体积变化关系如图所示。则下列说法正确的是( )(已知:H2CO3的电离平衡常数K1 = 4.3×107,K2 = 5.6×1011;Al(OH)3的酸式电离平衡常数K=6.3×1013)
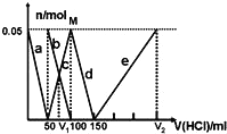
A. a曲线表示的离子方程式为:AlO2+4H+ = Al3+ + 2H2O
B. M点时生成的CO2为0.05 mol
C. 原混合溶液中的CO32与AlO2的物质的量之比为1:2
D. V1:V2=1:4
查看答案和解析>>
科目: 来源: 题型:
【题目】金属及其化合物在科学研究和工业生产中具有重要的用途。
(1)三氯化铁溶液用于检验食用香精乙酰乙酸乙酯时,会生成紫色配合物,其配离子结构如图所示:
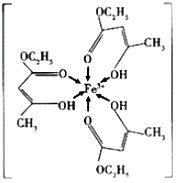
①此配合物中,铁离子价电子排布图为_______________;
②此配离子中碳原子的杂化轨道类型为_________________;
③此配离子中含有的化学键为_______________。
A 离子键 B 金属键 C 极性键 D 非极性键 E 配位键 F 氢键 G σ键 H π键
(2)NO2-与钴盐形成的配离子[Co(NO2)6]3-可用于检验K+的存在。NO2-离子的VSEPR模型名称为_____,K3[Co(NO2)6]是黄色沉淀,该物质中四种元素的电负性由大到小的顺序是_________。
(3)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2,其中适合作录音带磁粉原料的是_____。
(4)锰的一种配合物的化学式为Mn(BH4)2(THF)3,写出两种与BH4-互为等电子体的微粒____(请写一个分子和一个离子)。
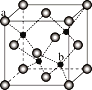
(5)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛,立方ZnS晶体的结构如图所示,a的配位数为_____,已知晶胞密度为ρ g/cm3,则晶包的棱长为_____nm(NA表示阿伏伽德罗常数)。
查看答案和解析>>
科目: 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是
A. NaHCO3(s) ![]() Na2CO3(s)
Na2CO3(s) ![]() NaOH(aq)
NaOH(aq)
B. Al(s)![]() NaAlO2(aq)
NaAlO2(aq)![]() Al(OH)3(s)
Al(OH)3(s)
C. AgNO3(aq)![]() [Ag(NH3)2]+(aq)
[Ag(NH3)2]+(aq)![]() Ag(s)
Ag(s)
D. Fe2O3(s)![]() Fe(s)
Fe(s)![]() FeCl3(aq)
FeCl3(aq)
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)碳化硅(SiC)是一种晶体,具有类似金刚石的结构,其中碳原子和硅原子的位置是交替的。下列各种晶体:①晶体硅 ②硝酸钾 ③金刚石 ④碳化硅 ⑤干冰 ⑥冰,它们的熔点由高到低的顺序是___________(填序号)。
(2)下列离子晶体的立体构型示意图,如下图所示。

以M代表阳离子,以N代表阴离子,写出各离子晶体的组成表达式。
A.__________,B:________,C:________,D:_____________。
(3)已知FeS2晶体(黄铁矿的主要成分)具有A的立体结构。
①FeS2晶体中具有的化学键类型是______________。
②若晶体结构A中相邻的阴、阳离子间的距离为acm,且用NA代表阿伏加德罗常数,则FeS2晶体的密度是________g·cm-3。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)写出SO3分子的空间构型是____;是____分子(填“极性”或“非极性”);常见的等电子体的化学式:一价阴离子______ (写出一种),它们的中心原子采用的杂化方式都是_______。
(2)甲醛(H2C=O)在Ni催化作用下加氢可得甲醇(CH3OH)。甲醇分子内C原子的杂化方式为__,甲醇分子内的O—C—H键角___(填“>”“<”或“=”)甲醛分子内的O—C—H键角,甲醇极易溶于水,其主要原因是_____。
(3)已知高碘酸有两种形式,化学式分别为H5IO6和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_____(填“>”“<”或“=”)HIO4。
查看答案和解析>>
科目: 来源: 题型:
【题目】2016年IUPAC命名117号元素为Ts(中文名“![]() ”,tián),Ts的原子核外最外层电子数是7。下列说法不正确的是
”,tián),Ts的原子核外最外层电子数是7。下列说法不正确的是
A.Ts是第七周期第ⅦA族元素
B.Ts的同位素原子具有相同的电子数
C.Ts在同族元素中非金属性最弱
D.中子数为176的Ts核素符号是![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】工厂排放的SO2烟气对环境造成污染,某企业用下图流程综合处理,下列有关说法正确的是

A. 二氧化硫吸收塔中发生的反应为SO2+SO32-+H2O=2HSO3-
B. 氨气吸收塔中发生的反应为HSO3-+OH-=H2O+SO32-
C. 上述流程利用的是氧化还原反应原理
D. 上述流程可循环利用的物质有2种
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组离子在指定的溶液中能大量共存的是( )
A. 常温下,水电离的c(OH-)= 1×10-12mo1·L-1的溶液中:NH4+、Fe2+、SO42-、NO3-
B. 能使酚酞变红的溶液中:Na+、Ba2+、HC2O4-、Cl-
C. 0. 1 mol·L1KI 溶液:Na+、K+、ClO 、OH
D. 常温下,![]() =10-10的溶液中:K+、Na+、I-、SO42-
=10-10的溶液中:K+、Na+、I-、SO42-
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。试回答下列问题:

(1)写出24号元素Cr的基态原子的电子排布式____________。
(2)元素e的基态原子的电子排布图:_______________。
(3)c有_____种运动不同的电子
(4)比较g、h、i三种元素的第一电离能的大小顺序:_______________(按由大到小的顺序排列,用元素符号表示)。
(5)图中o、p两元素的部分电离能数据列于下表:
元素 | o | p | |
电离能/(kJ·mol-1) | I1 | 717 | 759 |
I2 | 1 509 | 1 561 | |
I3 | 3 248 | 2 957 | |
比较两元素的I2、I3可知,气态o2+再失去一个电子比气态p2+再失去一个电子难。对此,你的解释是___________。
(6)第3周期主族元素按单质熔点高低的顺序如图所示,横坐标序号“8”代表______(填元素符号,下同)其中电负性最大的是____。

查看答案和解析>>
科目: 来源: 题型:
【题目】为探究某固体化合物X(仅含两种元素)的组成和性质,设计并完成如下实验,请回答:
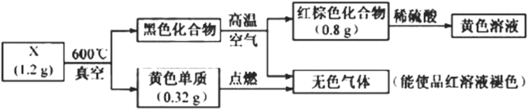
(1)X中的非金属元素是____,检验黄色溶液中的金属阳离子加入化学试剂是___。
(2)黑色化合物![]() 红棕色化合物的化学方程式是____。
红棕色化合物的化学方程式是____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com