
科目: 来源: 题型:
【题目】有四种不同堆积方式的金属晶体的晶胞如图所示,有关说法正确的是( )
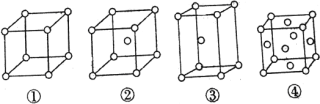
A. ①为简单立方堆积,②为六方最密堆积,③为体心立方堆积,④为面心立方最密堆积
B. 每个晶胞含有的原子数分别为①1个②2个③4个④4个
C. 晶胞中原子的配位数分别为①6 ②8 ③12 ④12
D. 空间利用率的大小关系为①<②<③<④
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值。下列说法正确的是
A.15g14CO与15N2的混合气体所含质子数为7.5NA
B.11.2LCl2与NaOH溶液反应转移电子数为0.5NA
C.2molSO2与1mol02反应生成SO3的分子数为2NA
D.48gO2和O3的混合气体中含有3NA个氧原子
查看答案和解析>>
科目: 来源: 题型:
【题目】BaCl2可用于电子、仪表等工业。以毒重石(主要成分为BaCO3,含少量的CaCO3、MgSO4、Fe2O3、SiO2等杂质)为原料,模拟工业制取BaCl2·2H2O的流程如下图所示:

已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9
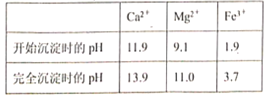
(1)盐酸浸取时需要适当加热的原因是_________。
(2)用37%的盐酸配制15%的盐酸需用到的仪器有________(填字母)
A.量筒 B.烧杯 C.容量瓶 D.玻璃棒
(3)滤渣I的成分为__________;
(4)Mg(OH)2的溶度积常数Ksp=_______,加入H2C2O4时发生的离子反应为_______,加入H2C2O4应避免过量,其原因是_________。
(5)母液中除了含有Ba2+、Cl—外,还含有大量的_________(填离子符号);
(6)滤渣III(不含结晶水)是结石的主要成分滤渣Ⅲ经过洗涤干燥后在空气中进行热重分析,取128.0g该纯净物,在200~470℃灼烧,最后得到100.0g产物,200~470℃时发生反应的化学方程式为___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】一种镁-过氧化氢燃料电池的原理为Mg + H2O2 + H2SO4=MgSO4+ 2H2O ,其装置如图所示。下列说法错误的是
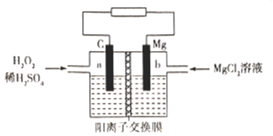
A.a极发生还原反应B.电子由b极经电解质溶液流向a极
C.Mg2+由右侧经过阳离子交换膜移向左侧D.b极电极反应式为Mg-2e-=Mg2+
查看答案和解析>>
科目: 来源: 题型:
【题目】回答下列问题:
(1)已知室温下CO的燃烧热为283kJ/mol,则CO的燃烧热的热化学方程式为____。
(2)工业上利用CO和H2合成清洁能源CH3OH,其反应为:CO(g)+2H2(g)![]() CH3OH(g) H=-116kJ/mol,如图①表示CO的平衡转化率(
CH3OH(g) H=-116kJ/mol,如图①表示CO的平衡转化率(![]() )随温度和压强变化的示意图中横坐标X表示的是_________,Y1______Y2(填“<”、“=”、“>”);
)随温度和压强变化的示意图中横坐标X表示的是_________,Y1______Y2(填“<”、“=”、“>”);
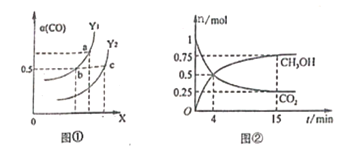
(3)合成甲醇的反应原理为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),在0.5L的密闭器中,充入1 mol CO2和3molH2,在500℃下生反应,测得CO2(g和CH3OH(g)的量随时间变化如图②所示。
CH3OH(g)+H2O(g),在0.5L的密闭器中,充入1 mol CO2和3molH2,在500℃下生反应,测得CO2(g和CH3OH(g)的量随时间变化如图②所示。
①反应进行到4min时,v(正)____v(逆)(填“<”、“=”、“>”),0~4min,H2的平均反应速率v(H2)=_____________;
②该温度下平衡常数为_____________;
③下列能说明该反应已达到平衡状态的是___________;
A. v正(CH3OH)=3v逆(H2)
B.CO2、H2、CH3OH和H2O浓度之比为1:3:1:1
C.恒温恒压下,气体的体积不再变化
D.恒温恒容下,气体的密度不再变化
(4)为提高燃料的能量利用率,常将其设计为燃料电池。某电池以甲醇为燃料,空气为氧化剂,KOH溶液为电解质溶液,以具有催化作用和导电性能的稀土金属为电极写出该燃料电池的负极反应式:_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z三种短周期元素,原子半径的大小关系为r(Y)>r(X)>r(Z),原子序数之和为16。X、Y、Z三种元素的常见单质在适当的条件下可发生如图所示的变化,其中A为X、Y组成的双原子分子,B和C均为10电子分子。下列说法不正确的是
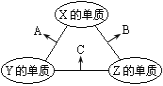
A.X元素位于第ⅥA族B.A不能溶于B中
C.A和C不可能发生氧化还原反应D.C溶于B形成的溶液呈碱性
查看答案和解析>>
科目: 来源: 题型:
【题目】氮及其化合物的转化过程如图所示,下列分析合理的是
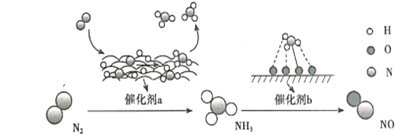
A. 催化剂a表面发生了极性共价键的断裂和形成
B. 在催化剂b表面形成氮氧键时,不涉及电子转移
C. N2与H2反应生成NH3的原子利用率为100%
D. 催化剂a、b能提高反应的平衡转化率
查看答案和解析>>
科目: 来源: 题型:
【题目】已知反应:NO2(g) + SO2(g)![]() SO3(g) + NO(g) ,起始时向某密闭容器中通入1 mol NO2 、 2 mol S18O2,.反应达到平衡后,下列有关说法正确的是:
SO3(g) + NO(g) ,起始时向某密闭容器中通入1 mol NO2 、 2 mol S18O2,.反应达到平衡后,下列有关说法正确的是:
A.NO2中不可能含18OB.有1 mol N18O生成
C.S18O2的物质的量不可能为0. 8 molD.SO2、SO3、NO、NO2均含18O时,说明该反应达到平衡
查看答案和解析>>
科目: 来源: 题型:
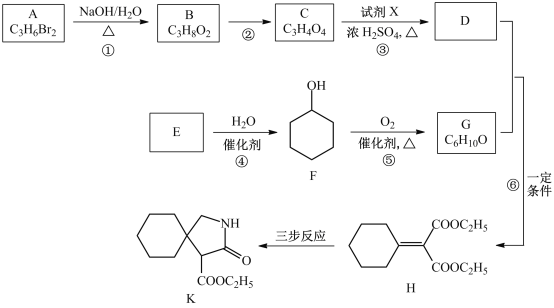
【题目】有机物K是某药物的前体,合成路线如图所示:
已知:R-CN![]()
![]() ;
;
![]()
![]() +
+![]()
(1)A的名称是_____________。
(2)反应①的化学方程式是___________________。
(3)反应②的类型是__________________。
(4)反应③中的试剂X是________________。
(5)E属于烃,其结构简式是_________________。
(6)H中所含的官能团是_________________。
(7)反应⑥的化学方程式是_____________________。
(8)H经三步反应合成K,写出中间产物I和J的结构简式______________。
![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关离子晶体的数据大小比较不正确的是( )
A. 晶格能:NaF>NaCl>NaBr
B. 硬度:MgO>CaO>BaO
C. 熔点:NaF>MgF2>AlF3
D. 阴离子的配位数:CsCl>NaCl>CaF2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com