
科目: 来源: 题型:
【题目】C60、金刚石、石墨、二氧化碳和氯化铯的结构模型如图所示(石墨仅表示出其中的一层结构):
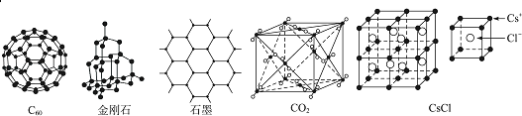
(1)C60、金刚石和石墨三者的关系是互为_____。
A.同分异构体 B.同素异形体 C.同系物 D.同位素
(2)固态时,C60属于_____(填“原子”或“分子”)晶体。
(3)晶体硅的结构跟金刚石相似,1mol晶体硅中含有硅﹣硅单键的数目约是_____NA。
(4)石墨层状结构中,平均每个正六边形占有的碳原子数是_____。
(5)观察CO2分子晶体结构的一部分,试说明每个CO2分子周围有_____个与之紧邻且等距的CO2分子;该结构单元平均占有_____个CO2分子。
(6)观察图形推测,CsCl晶体中两距离最近的Cs+间距离为a,则每个Cs+周围与其距离为a的Cs+数目为_____,每个Cs+配位数为_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A. PCl3的空间构型为平面三角形
B. HF、HCl、HBr、HI的熔沸点依次升高
C. 乳酸(![]() )有一对手性异构体,因为其分子中含有一个手性碳原子
)有一对手性异构体,因为其分子中含有一个手性碳原子
D. 氯的各种含氧酸的酸性由强到弱排列为HClO>HClO2>HClO3>HClO4
查看答案和解析>>
科目: 来源: 题型:
【题目】为了探究氯、溴、硫的非金属性强弱,设计如下实验装置(加热及夹持装置已略)。

(1)仪器a的名称是______。试剂X是_____________。
(2)写出装置A中发生反应的化学方程式:__________________________________
(3)装置E中NaOH溶液的作用是____________________________________________
(4)反应一段时间后,观察到装置C中溶液变为橙黄色,说明非金属性:Cl___Br( 填“>"或"<")。
(5)打开装置C中的活塞,将装置C中的溶液逐渐滴人装置D中,振荡。观察到的现象是______________,写出可能发生反应的离子方程式:_____________________________________写一个即可),根据此现象不一定能说明溴的非金属性比硫强,原因是___________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】呋喃甲酸(![]() )俗名糠酸,其在塑料工业中可用作增塑剂、热固性树脂等。呋喃甲酸可由呋喃甲醛制备,其制备原理如下所示:
)俗名糠酸,其在塑料工业中可用作增塑剂、热固性树脂等。呋喃甲酸可由呋喃甲醛制备,其制备原理如下所示:
反应1: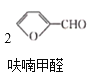 +NaOH→
+NaOH→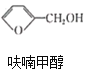 +
+![]() ;
;
反应2:![]() +HCl→
+HCl→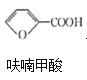 +NaCl;
+NaCl;
已知:I、反应1是放热反应;
II、乙醚的沸点是34.6℃,易挥发,遇明火易燃,其蒸气可使人失去知觉;
III、呋喃甲酸的溶解度随温度的升高而升高,且升温过程中溶解度变化较大;
实验步骤:向三颈烧瓶中加入16.4mL(约0.2mol)呋喃甲醛按以下流程图制备并获得粗品,粗品进一步提纯得到精产品9.5g
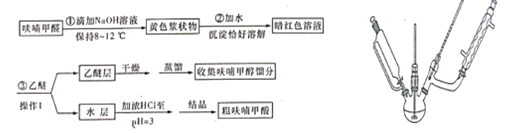
(1)若用如上图装置作为反应1的发生装置图中有一处明显错误的地方是________。
(2)步骤①中,为控制反应温度在8~12℃,可采取的措施有①____________;②________。
(3)操作1的名称为__________,要用到的玻璃仪器有______。
(4)在对乙醚层进行分离时,用下图中的_______(填字母代号)装置更好,与另一装置相比,该装置具有以下优点:
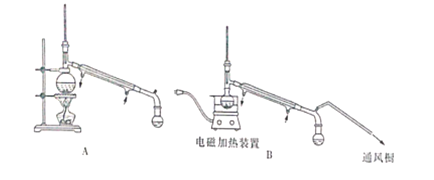
①______________;②___________。
(5)经过结晶得到的粗呋喃甲酸若要进一步提纯,要经过热水溶解→活性炭脱色→蒸发→浓缩→_______→______→抽滤→洗涤→干燥。
(6)呋喃甲酸的产率为______(保留三位有效数字)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述正确的是( )
①不同核素之间形成的共价键一定是极性键②当一个碳原子连接四个不同的原子或原子团时,该碳原子叫手性碳原子③Ge是ⅣA族的一个主族元素,其核外电子排布式为Ge:[Ar]4s24p2,属于P区元素④非极性分子往往是高度对称的分子,比如BF3,PCl5,H2O,CO2这样的分子⑤冰中存在极性共价键和氢键两种化学键的作用⑥熔融状态的HgCl2不能导电,HgCl2的稀溶液有弱的导电能力且可作手术刀的消毒液,从不同角度分类HgCl2是一种共价化合物、电解质、盐⑦氨水中大部分NH3与H2O以氢键(用“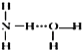 …”表示)结合成NH3H2O分子,根据氨水的性质可知NH3H2O的结构式为⑧σ键重叠方式为头碰头,成镜像对称;键重叠方式为肩并肩,成轴对称⑨干冰汽化破坏了共价键,氯化钠溶于水破坏了离子键.
…”表示)结合成NH3H2O分子,根据氨水的性质可知NH3H2O的结构式为⑧σ键重叠方式为头碰头,成镜像对称;键重叠方式为肩并肩,成轴对称⑨干冰汽化破坏了共价键,氯化钠溶于水破坏了离子键.
A. ②⑥B. ①②⑥C. ②⑤⑥⑧D. ③④⑥⑦⑨
查看答案和解析>>
科目: 来源: 题型:
【题目】下面有关晶体的叙述中,不正确的是( )
A. 60gSiO2晶体中含Si-O键的个数为4NA(NA为阿伏加德罗常数)
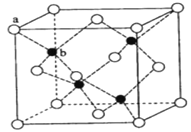
B. 在立方ZnS晶体(如图所示)中,Zn2+、S2-的配位数都是8
C. 设NaCl的摩尔质量为Mg·mol-1,NaCl的密度为ρg·cm-3,阿伏加德罗常数为NAmol-1,在NaCl晶体中,两个距离最近的Cl-中心间的距离为![]() cm
cm
D. CaO晶体结构与NaCl晶体结构相似,CaO晶体中Ca2+的配位数为6,且这些最邻近的O2-围成正八面体
查看答案和解析>>
科目: 来源: 题型:
【题目】已知①Na2O2②O2③HClO④H2O2⑤Cl2⑥NaClO⑦O3七种物质都具有强氧化性。请回答下列问题:
(1)上述物质中互为同素异形体的是_____(填序号,下同)。
(2)含非极性键的共价化合物是_____。
(3)属于离子化合物的有_____种。
(4)Na2O2、HCIO、H2O2均能用于制备O2。
①HClO在光照条件下分解生成O2和HCl,用电子式表示HCl的形成过程_____。
②写出Na2O2与H2O反应的方程式并标出电子转移方向和数目_____。
③H2O2在二氧化锰催化作用下可以制备O2。若6.8gH2O2参加反应,则转移电子数目为_____,生成标准状况下O2体积为_____L。
查看答案和解析>>
科目: 来源: 题型:
【题目】元素周期表是打开物质世界奧秘之门的一把金钥匙 ,1869年,门捷列夫发现了元素周期律并发表了元素周期表。下图为元素周期表的一部分,回答下列问题。
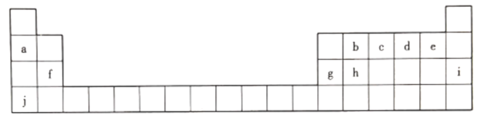
(1).上述元素中化学性质最稳定的是________(填元素符号,下同) ,非金属性最强的是_____。
(2)c的最高价氧化物对应水化物的化学式为__________。
(3)h元素的原子结构示意图为__________,写出h单质的一种用途:__________。
(4)b、d、f三种元素原子半径由大到小的顺序是__________(用元素符号表示)。
(5)a、g、j的氢氧化物中碱性最强的是__________(填化学式),写出其溶液与g的氧化物反应的离子方程式:___________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】甲烷既是重要的能源也是重要的化工原料。
已知反应CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g),起始时向体积为V的恒容密闭容器中通入2molCH4和3molNO2,测得CH4、N2、H2O的物质的量浓度与时间的关系如图所示。
N2(g)+CO2(g)+2H2O(g),起始时向体积为V的恒容密闭容器中通入2molCH4和3molNO2,测得CH4、N2、H2O的物质的量浓度与时间的关系如图所示。
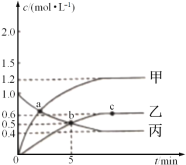
(1)容器体积V=_____L。
(2)图中表示H2O的物质的量浓度与时间关系的是曲线_____(填“甲”“乙"或"丙")。
(3)0~5min内,用N2表示的化学反应速率为_____mol·L-1·min-1。
(4)a、b、c三点中达到平衡的点是______。达到平衡时,NO2的转化率是_____。(物质平衡转化率=转化的物质的量/起始的物质的量×100%)。
(5)a点时,n(CH4):n(NO2)=_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com