
科目: 来源: 题型:
【题目】某中性有机物A的分子量为88,碳的质量分数为54.5%,氢的质量分数为9.1%,其余为氧。可发生如图所示变化:

(1)C中官能团的名称是__________ 。
(2)D→E的反应类型是____________。
(3)有机物A与氢氧化钠溶液反应的化学方程式为___________。
(4)已知某烃X的相对分子质量比A小16,分子中碳与氢的质量之比为5:1。下列说法正确的是________。
A.相同条件下X的密度比水小
B. 烃X能与氢气发生还原反应
C.甲烷与烃X互为同系物
D.C、D、E可用新制氢氧化铜检验
查看答案和解析>>
科目: 来源: 题型:
【题目】所示装置进行探究实验(浓硫酸和乙醇制备乙烯)。以验证产物中有乙烯生成且乙烯具有不饱和性.当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓硫酸与乙醇的混合液体变为棕黑色。
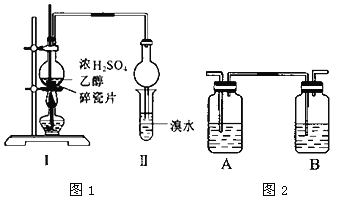
(1)写出该实验中生成乙烯的化学方程式___________。
(2)甲同学认为:考虑到该混合液体反应的复杂性,溴水褪色的现象不能证明反应中有乙烯生成,且乙烯具有不饱和性,其理由正确的是_______。(填字母序号)
A.乙烯与溴水易发生取代反应 B.使溴水褪色的反应,未必是加成反应
C.使溴水褪色的物质,未必是乙烯 D.浓硫酸氧化乙醇生成乙醛,也会使溴水褪色
(3)乙同学经过细致观察后认为试管中另一现象可证明反应中有乙烯生成,这个现象是________。
(4)丙同学对上述实验装置进行了改进,在I和Ⅱ之间增加如图2所示装置,则A中的试剂应为___,其作用是_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】微型纽扣电池在现代生活中有广泛应用。有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH溶液,电极反应为Zn+2OH--2e-=ZnO+H2O,Ag2O+H2O+2e-=2Ag+2OH-
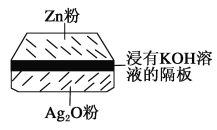
根据上述反应式,完成下列填空。
(1)下列叙述正确的是______。
A.在使用过程中,电解质溶液中的KOH被不断消耗,pH减小
B.使用过程中,电子由Ag2O极经外电路流向Zn极
C.Zn是负极,Ag2O是正极
D.Zn电极发生还原反应,Ag2O电极发生氧化反应
(2)写出电池的总反应式:___________。
(3)使用时,负极区的pH____(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】在2L密闭容器中把4molA和2molB混合,在一定条件下发生反应3A(g)+2B(g)![]() zC(g)+2D(g)。2min后反应达到平衡时生成1.6molC,又测得反应速率v(D)=0.2mol/(L·min)。则下列说法正确的是( )
zC(g)+2D(g)。2min后反应达到平衡时生成1.6molC,又测得反应速率v(D)=0.2mol/(L·min)。则下列说法正确的是( )
A.z=4
B.B物质的转化率是20%
C.A的平衡浓度是1.6mol/L
D.平衡时气体压强是原来的![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,下列叙述是可逆反应N2(g)+3H2(g)![]() 2NH3(g),在定容密闭容器中达到平衡的标志的是 ( )
2NH3(g),在定容密闭容器中达到平衡的标志的是 ( )
①NH3的生成速率与NH3的分解速率相等;
②单位时间内amolN2生成,同时生成3amolH2;
③N2的浓度不再变化;
④混合气体的总压强不再变化;
⑤混合气体的平均摩尔质量不再变化;
⑥用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1:3:2;
⑦N2、H2、NH3的分子数目比为1:3:2;
A.②⑤ B.①③④⑤ C.②⑥⑦ D.⑤⑥
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是某兴趣小组同学设计的原电池装置,下列叙述正确的是( )
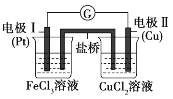
A.电极I上发生氧化反应
B.可将CuCl2溶液改为KCl溶液
C.该原电池的总反应为Fe3++Cu=Cu2++Fe2+
D.盐桥中装有含氯化钾的琼脂,K+移向CuCl2溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A(g)+B(g)![]() C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
温度/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的平衡常数表达式K=____,ΔH=___(填“<”、“>”或“=”)0。
(2)830℃时,向一个5 L的密闭容器中充入0.20molA和0.80molB,如反应初始6s内A的平均反应速率v(A)=0.003 mol·L-1·s-1。则6 s时c(A)=____mol·L-1,C的物质的量为___mol;若反应经一段时间后,达到平衡时A的转化率为____,如果这时向该密闭容器中再充入1 mol氩气,平衡时A的转化率为_____。
(3)判断该反应是否达到平衡的依据为_____。
a.压强不随时间改变
b.气体的密度不随时间改变
c.c(A)不随时间改变
d.单位时间里生成C和D的物质的量相等
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能I1(Zn)___I1(Cu)(填“大于”或“小于”)。
(2)基态Fe2+的电子排布式为___。
(3)在N、Mg、Al、Si四种元素中,有一种元素的电离能数据如下:
电离能 | I1 | I2 | I3 | I4 | … |
I0/kJ·mol-1 | 578 | 1817 | 2745 | 11575 | … |
则该元素的元素符号是___。
(4)NO3-的空间构型__(用文字描述),SO42-中硫原子的杂化方式为___。
(5)LiAlH4是有机合成中常用的还原剂,LiAlH4中的阴离子空间构型是___、中心原子的杂化形式为___。根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是___。
(6)与O3分子互为等电子体的一种阴离子为___(填化学式)。
(7)N2分子中σ键与π键的数目比n(σ):n(π)=___。
(8)Cu、N两元素形成的某化合物的晶胞结构如图所示,则该化合物的化学式是___(用元素符号表示);若晶胞的棱长a nm,阿伏加德罗常数为NA,则该晶体的密度为___g/cm3(用含a、NA的式子表示)。
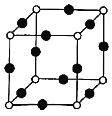
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,将浓度均为0.1mol/L,体积分别为Va和Vb的HA溶液与BOH溶液按不同体积比混合,保持Va+Vb=100mL,Va、Vb与混合液pH的关系如图所示,下列说法正确的是
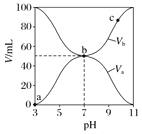
A. Ka=1×10-6
B. b点时,c(B+)=c(A-)
C. c点时,![]() 随温度升高而增大
随温度升高而增大
D. a→c过程中水的电离程度始终增大
查看答案和解析>>
科目: 来源: 题型:
【题目】某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见下图,电池总反应可表示为2H2+O2==2H2O,下列有关说法正确的是()
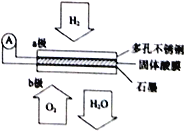
A. 电子通过外电路从b极流向a极
B. b极上的电极反应式为:O2+2H2O+4e-=4OH-
C. 每转移0.1 mol电子,便消耗1.12 升的H2
D. H+由a极通过固体酸电解质传递到b极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com