
科目: 来源: 题型:
【题目】实验室用100mLNaOH溶液捕获CO2,一定时间后,测定CO2的吸收量。充分反应后,再向所得溶液中逐滴加入2.0mol/L的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示。回答下列问题:

(1)原NaOH溶液的物质的量浓度为______;
(2)题中通入CO2后所得溶液中的溶质有______,溶液中溶质的物质的量之比为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】CuCl广泛应用于化工和印染等行业。某研究性学习小组拟热分解结晶水合物CuCl·2H2O制备CuCl,并进行相关探究。
查阅资料:CuCl22H2O ![]() CuCl2
CuCl2 ![]() CuCl+Cl2;CuCl22H2O
CuCl+Cl2;CuCl22H2O![]() Cu2(OH)2Cl2
Cu2(OH)2Cl2![]() CuO
CuO
(实验探究)该小组用下图所示装置进行实验(夹持仪器略)。
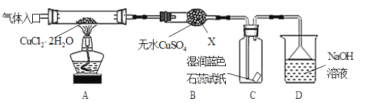
请回答下列问题:
(1)仪器X的名称是___;装置D中倒扣的三角漏斗的作用是_____;
(2)实验操作的先后顺序是a→____→____→____→e (填操作的编号)。
a.检查装置的气密性后加入药品 b.熄灭酒精灯,冷却 c.在“气体入口”处通入干燥HCl d.点燃酒精灯,加热 e.停止通入HCl,然后通入N2
(3)在实验过程中,观察到B中物质由白色变为蓝色,C中试纸的颜色变化是____;
(4)装置D中发生的氧化还原反应的离子方程式是_____;
(5)反应结束后,取出CuCl产品进行实验,发现其中含有少量的CuCl2或CuO杂质,根据资料信息
①若杂质是CuCl2,则产生的原因是____;
②若杂质是CuO,则产生的原因是____。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)①写出漂白粉的有效成分的化学式_____;
②用系统命名法给有机物CH3CH(CH3)2命名________。
(2)①写出碳与浓硫酸反应的化学方程式______;
②写出乙醇与金属钠反应的方程式_______。
(3)H2O2和Fe3+都具有氧化性,氧化性强弱关系为H2O2____Fe3+(填“>”“<”或“=”),用有关的离子反应方程式证明以上结论____。
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,在一个2 L的密闭容器中,加入4 mol A和2 mol B进行如下反应3A(g)+2B(g) ![]() 4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6 mol C,则下列说法正确的是( )
4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6 mol C,则下列说法正确的是( )
A. 该反应的化学平衡常数表达式是![]()
B. 此时,B的平衡转化率是40%
C. 增大该体系的压强,化学平衡常数增大
D. 增加B,B的平衡转化率增大
查看答案和解析>>
科目: 来源: 题型:
【题目】用CO和H2合成CH3OH的化学方程式为CO(g)+2H2(g) ![]() CH3OH(g) AH<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示,下列说法正确的是( )
CH3OH(g) AH<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示,下列说法正确的是( )

A. 温度:T1>T2>T3
B. 正反应速率:v(a)>v(c), v(b)>v(d)
C. 平衡常数:K(a)>K(c),K(b)=K(d)
D. 平均摩尔质量:M(a)<M(c),M(b)<M(d)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A. 强电解质溶液的导电能力一定比弱电解质溶液的强
B. 一定温度下,可逆反应2X(g)+Y(g)![]() 2Z(g)达到平衡的标志是:容器内X、Y、Z的物质的量之比为2:1:2
2Z(g)达到平衡的标志是:容器内X、Y、Z的物质的量之比为2:1:2
C. 升高温度,AgCl的溶解度增大,Ksp增大
D. FeCl3、KAl(SO4)2、Na2CO3的水溶液均显酸性
查看答案和解析>>
科目: 来源: 题型:
【题目】固体粉末 X 中可能含有 Fe2O3、CuO、MnO2、CaO、NaCl 和 K2CO3 中的若干种。为确定该固体粉末的成分,进行了以下实验(所加试剂均过量):
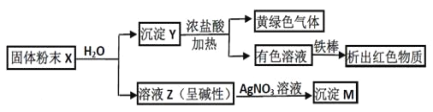
下列结论正确的是:
A. 固体粉末中一定含 K2CO3B. X 中可能存在 Fe2O3
C. 沉淀 M 一定含 AgClD. 沉淀 Y 中不一定存在 MnO2
查看答案和解析>>
科目: 来源: 题型:
【题目】T℃,将2 mol X和1 mol Y充入体积为1L的密闭容器中,已知:2X(s)+Y(g) ![]() 2Z(g) △H=-M kJ·mol-1。10 min后达到平衡,生成0.2 mol Z,共放出热量N kJ,下列说法正确的是
2Z(g) △H=-M kJ·mol-1。10 min后达到平衡,生成0.2 mol Z,共放出热量N kJ,下列说法正确的是
A. 在第10 min时,Z的反应速率为0.02 mol·L-1·min-l
B. 在0~10 min内,Y的反应速率为![]() mol·L-1·min-l
mol·L-1·min-l
C. 增加X的物质的量可以加快反应速率
D. 反应达平衡后,保持T℃,通入稀有气体增加压强,则化学反应速率变快
查看答案和解析>>
科目: 来源: 题型:
【题目】原子结构与性质
(1)元素As与N同族。As的氢化物沸点比NH3的___(填“高”或“低”),其判断理由是______。
(2)铜原子在基态时的价电子排布式为______。
(3)Fe是人体需要补充的元素之一,试写出Fe2+的核外电子排布式:_____。与Al同一周期的Na、Mg元素也是人体所需元素,Na、Mg、Al基态原子第一电离能的大小关系____。某同学所画基态镁原子的核外电子排布图如图![]() ,该同学所画的电子排布图违背了______。
,该同学所画的电子排布图违背了______。
(4)K元素处于元素周期表的____区,其基态原子中,核外电子占据的电子云轮廓图为球形的能级有____个。
查看答案和解析>>
科目: 来源: 题型:
【题目】砷为VA族元素,金属冶炼过程产生的含砷有毒废弃物需处理与检测。
I.冶炼废水中砷元素主要以亚砷酸(H3AsO3)形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如图:
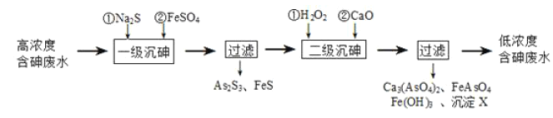
已知:①As2S3与过量的S2-存在以下反应:As2S3(s)+3S2-(aq)![]() 2AsS33-(aq);
2AsS33-(aq);
②亚砷酸盐的溶解性大于相应砷酸盐。
(1)亚砷酸中砷元素的化合价为____;砷酸的第一步电离方程式为______。
(2)“一级沉砷”中FeSO4的作用是_____;“二级沉砷”中H2O2与含砷物质反应的化学方程式为_______。
(3)沉淀X为____(填化学式)。
Ⅱ.冶炼废渣中的砷元素主要以As2S3的形式存在,粉碎后与锌粉混合,加入H2SO4共热,生成AsH3气体。将AsH3气体通入AgNO3溶液中,生成银镜和As2O3。
(4)AsH3的电子式为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com