
科目: 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次 增大。在如图所示的物质转化关系中,p、q、 m.n分别是元素W、X、Y、Z的气体单质,p和 s均为有色气体,v的水溶液呈碱性。常温下,0.1 mol L -1 ,t 溶液与 0.1 mol L -1 u 溶液的pH均为1。下列说法不正确的是
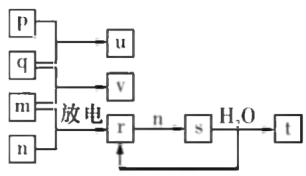
A.Y、W的兹高价氧化物对应的水化物均为强酸
B.元索的非金属性:Z>Y>X;原子半径:X<Z<Y
C.s溶于水的反应中,氧化剂与还原剂的物质的量之比为1:2
D.的电子式可表示为![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】某科学家利用二氧化饰(CeO2)在太阳能作用下将H2O、CO2转变为H2、 CO,其过程如下所示:
mCeO2![]() (m-x)CeO2·xCe+xO2
(m-x)CeO2·xCe+xO2
(m-x)CeO2·xCe+x H2O+xCO2![]() mCeO2+xH2+xCO2
mCeO2+xH2+xCO2
下列说法不正确的是
A.该过程中CeO2是H2O、CO2转变为H2、CO反应的催化剂
B.利用CeO2作催化剂-既可使该转变过程速率提高。亦可减小能量的消 耗,并可提高反应物转化率
C.mmol CeO2参加反应,气体物质的量增加x mol
D.以CO和O2构成的碱性燃料电池的负极反应式为CO+4OH - - 2e = CO32- +2H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】某校化学研究性学习小组欲设计实验验证Fe、Cu的金属活动性,他们提出了以下两种方案。请你帮助他们完成有关实验项目。
(1)方案Ⅰ:有人提出将大小相等的铁片和铜片同时放入稀硫酸(或稀盐酸)中,观察产生气泡的快慢,据此确定它们的活动性。该原理的离子方程式为___。
(2)方案Ⅱ:有人利用Fe、Cu作电极设计成原电池,以确定它们的活动性。试在下面的方框内画出原电池装置图,标出原电池的电极材料和电解质溶液,并写出负极的电极反应式___。

(3)方案Ⅲ:结合你所学的知识,帮助他们再设计一个验证Fe、Cu活动性的简单实验方案及现象(与方案Ⅰ、Ⅱ不能雷同):___。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知锌与稀盐酸反应放热,某学生为了探究反应过程中的速率变化,用排水集气法收集反应放出的氢气。所用稀盐酸浓度有1.00mol·L-1、2.00mol·L-1两种浓度,每次实验稀盐酸的用量为25.00mL,锌有细颗粒与粗颗粒两种规格,用量为6.50g。实验温度为298K、308K。
(1)完成以下实验设计(填写表格中空白项),并在实验目的一栏中填出对应的实验编号:
编号 | T/K | 锌规格 | 盐酸浓度/mol·L-1 | 实验目的 |
① | 298 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究盐酸浓度对该反应速率的影响; (Ⅱ)实验①和___探究温度对该反应速率的影响; (Ⅲ)实验①和___探究锌规格(粗、细)对该反应速率的影响。 |
② | 298 | 粗颗粒 | 1.00 | |
③ | 308 | 粗颗粒 | 2.00 | |
④ | 298 | 细颗粒 | 2.00 |
(2)实验①记录如下(换算成标况):
时间(s) | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
氢气体积(mL) | 16.8 | 39.2 | 67.2 | 224 | 420 | 492.8 | 520.8 | 543.2 | 554.4 | 560 |
①计算在30s~40s范围内盐酸的平均反应速率ν(HCl)=___(忽略溶液体积变化)。
②反应速率最大的时间段(如0s~10s......)为___,可能原因是___。
③反应速率最小的时间段为___,可能原因是___。
(3)另一学生也做同样的实验,由于反应太快,测量氢气的体积时不好控制,他就事先在盐酸溶液中分别加入等体积的下列溶液以减慢反应速率,在不影响产生H2气体总量的情况下,你认为他上述做法中可行的是___(填相应字母);
A.蒸馏水 B.NaNO3溶液 C.NaCl溶液 D.CuSO4溶液 E.Na2CO3
(4)某化学研究小组的同学为比较Fe3+和Cu2+对H2O2分解的催化效果,分别设计了如图甲、乙所示的实验。请回答相关问题:
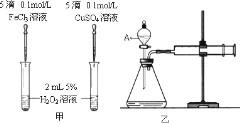
①定性如图甲可通过观察___,定性比较得出结论。甲同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是___。受甲同学的启发乙同学提出了另一种方案,你猜想乙同学的方案是___;
②定量如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略,实验中需要测量的数据是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A. 1mol—OH含10NA个电子
B. 1molC2H518OH与足量CH3COOH充分反应可得NA个H2O
C. 标准状况下,11.2L丙烯所含的极性共价键数为3NA
D. 常温下,将1mol铁加入到足量的浓硝酸中,生成NO2气体的体积大于67.2L
查看答案和解析>>
科目: 来源: 题型:
【题目】用序号填写下列空格:
①O2和O3②H2、D2和T2③12C和14C④石墨和足球烯(C60)⑤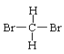 和
和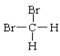 ⑥正丁烷和异丁烷⑦
⑥正丁烷和异丁烷⑦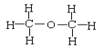 和
和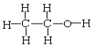 ⑧CH3CH3和CH3CH2CH2CH3
⑧CH3CH3和CH3CH2CH2CH3
互为同素异形体的是___;互为同位素的是__,互为同分异构体的是__,互为同系物的是__,同一种物质的是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】手持技术的氧电化学传感器可用于测定 O2含量,右图为某种氧电化学传感器的 原理示意图。已知在测定O2含量过程 中,电解质溶液的质量保持不变。一定时 间内,若通过传感器的待测气体为aL(标 准状况),某电极增重了b g。下列说法正确的是
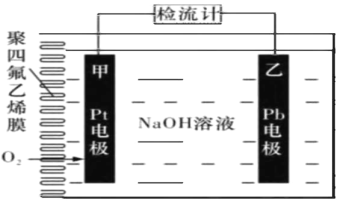
A.Pt电极为负极
B.反应过程中转移OH-的物质的量为0.125bmol
C.Pb电极上发生的电极反应为Pb-2e- +2OH- = Pb(OH)2
D.待测气体屮氧气的体积分数为![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定条件下,容积为2L的密闭容器中,将2molM气体和3molN气体混合,发生下列反应:2M(g) + 3N(g)![]() xQ(g) + 3R(g),该反应达到平衡时生成2.4molR,并测得Q浓度为0.4 mol·L-1,下列叙述正确的是
xQ(g) + 3R(g),该反应达到平衡时生成2.4molR,并测得Q浓度为0.4 mol·L-1,下列叙述正确的是
A. X值为2 B. 容器内压强不变
C. 平衡时N的浓度为0.6mol/L D. M的转化率为80%
查看答案和解析>>
科目: 来源: 题型:
【题目】深埋在潮湿土壤中的铁管道,在硫酸盐还原菌(一种厌氧微生物)的作用下,能被硫酸根离子腐蚀,其电化学腐蚀原理如图所示。下列与此原理有关的说法错误的是
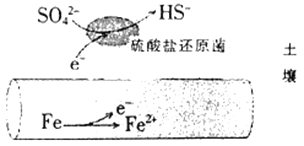
A.负极反应为SO42-+5H2O+8e-=HS-+9OH-
B.输送暖气的管道不易发牛此类腐蚀
C.这种情况下,Fe腐蚀的最终产物为FeO或Fe(OH)2
D.管道上刷富锌油漆可以延缓管道的腐蚀
查看答案和解析>>
科目: 来源: 题型:
【题目】设Na为阿伏加德罗常数的值。已知反应:
①CH4 (g) +2O2 (g) = CO2 (g) +2H2O(l) △H1 =a kJ mol -1
②CH4(g) + 2O2 (g) = CO2 (g) +2H2O(g) △H2 =bkJ mol-1
键能定义:在标准状况下,将1 mol气态分子AB(g)解离为气态原子
A(g)、B(g)所需的能量。已知1 mol氧气的键能为xkJ。其他数据如下 表所示,下列说法正确的是
化学键 | C—O | C—H | O—H |
键能/(kJ mol-1) | 798 | 413 | 463 |
A.上文中x=![]()
B.H2O(g) = H2O(1)的△S<0、△H=(a — b) kJ mol -1
C.当有4NA个O—H键生成时,反应放出的热量为a kJ
D.利用反应①设计的原电池电解精炼铜,当负极输出0.2NA个电子时. 理论上电解槽的阴极质量增重6.4 g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com