
科目: 来源: 题型:
【题目】锌钡白是BaSO4和ZnS的混合物,ZnS难溶于水。某化工厂用重晶石为原料制备锌钡白,生产过程中会产生大量废气(主要成分为CO2、CO及少量SO2和硫蒸气等),为防止污染空气并提高原料利用率,生产中采用下述工艺流程:
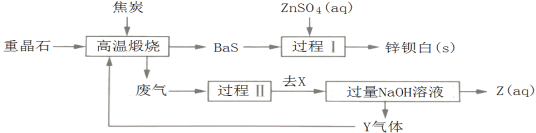
下列叙述错误的是
A.重晶石和钡餐的化学成分相同
B.Y气体的循环使用可以防止污染空气并能提高原料利用率
C.Z(aq)中的阴离子是OH-和CO32-
D.高温煅烧过程中焦炭的作用是为反应提供热量和作还原剂
查看答案和解析>>
科目: 来源: 题型:
【题目】在一个绝热容积不变的密闭容器中发生N2(g)+3H2(g)![]() 2NH3(g) △H<0。下列各项能说明该反应已经达到反应限度的是( )
2NH3(g) △H<0。下列各项能说明该反应已经达到反应限度的是( )
A.容器内气体的总质量保持不变
B.断裂lmolN≡N键的同时断裂3molH-H键
C.容器中H2的浓度保持不变
D.v(N2):v(H2):v(NH3)=1:3:2
查看答案和解析>>
科目: 来源: 题型:
【题目】一块11.0 g的铁铝合金,加入一定量的稀硫酸后合金完全溶解,然后加H2O2到溶液中无Fe2+存在,加热除去多余的H2O2,当加入200 mL 6 molL﹣1NaOH溶液时沉淀量最多,且所得沉淀质量为26.3 g,下列说法不正确的是
A.该合金中铁的质量为5.6 g
B.合金与稀硫酸反应共生成0.45 mol H2
C.该合金与足量氢氧化钠反应,转移的电子数为0.6 NA
D.所加的稀硫酸中含0.6 mol H2SO4
查看答案和解析>>
科目: 来源: 题型:
【题目】元素周期表前四周期A、B、C、D、E五种元素,A元素的原子最外层电子排布式为ms1;B元素的原子价电子排布式为ns2np2;C元素位于第二周期且原子中p能级与s能级电子总数相等;D元素原子的M能层的p能级中有3个未成对电子;E元素原子有五个未成对电子。
(1)E元素原子的价电子排布式是______,在元素周期表中位置是_____,其最高价氧化物的化学式是__________。
(2)C基态原子的电子排布图为_____,若A为非金属元素,则按原子轨道的重叠方式,A与C形成的化合物中的共价键属于_____键(填“σ”或“π”)。
(3)当n=3时,B与C形成的化合物与氢氧化钠溶液反应的离子方程式是_______。
(4)若A元素的原子最外层电子排布为2s1,B元素的原子价电子排布为3s23p2,A、B、C、D四种元素的电负性由大到小的顺序是_____(用元素符号表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,在2L的恒容密闭容器中发生反应A(g)+2B(g)![]() 3C(g)。反应过程中的部分数据如下表所示:
3C(g)。反应过程中的部分数据如下表所示:
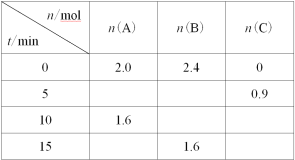
下列说法正确的是( )
A.0~5min用A表示的平均反应速率为0.09mol·L1·min1
B.该反应在10min后才达到平衡
C.平衡状态时,c(C)=0.6mol·L1
D.物质B的平衡转化率为20%
查看答案和解析>>
科目: 来源: 题型:
【题目】下图所示为某种胃药的核心合成反应部分过程:
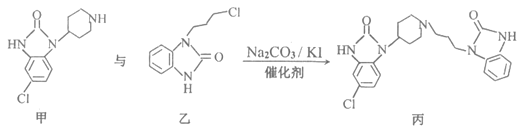
下列说法正确的是( )
A.甲中的两个![]() 键的活性相同B.乙所有原子在同一平面上
键的活性相同B.乙所有原子在同一平面上
C.丙的分子式![]() D.该反应生成丙的原子利用率小于100%
D.该反应生成丙的原子利用率小于100%
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不正确的是( )
A.室温下浓度均为0.1 mol/L的盐酸和氨水混合呈中性时,消耗盐酸的体积大于氨水
B.室温下向0.1 mol/L氨水中加入等浓度等体积的盐酸,溶液导电能力增强
C.室温下pH相等的CH3COOH溶液和盐酸中,c(OH-)相等
D.室温下pH=1的CH3COOH溶液和pH=13的NaOH溶液中,c(CH3COO-)=c(Na+)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关热化学方程式的叙述正确的是( )
A.已知C(石墨,s)![]() C(金刚石,s) △H>0,则金刚石比石墨稳定
C(金刚石,s) △H>0,则金刚石比石墨稳定
B.含20.0gNaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则该反应的热化学方程式为:NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H=-57.4kJ/mol
C.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
D.N2(g)+3H2(g)![]() 2NH3(g);△H=-akJ·mol-1,则将14gN2(g)和足量H2置于一密闭容器中,充分反应后放出0.5akJ的热量
2NH3(g);△H=-akJ·mol-1,则将14gN2(g)和足量H2置于一密闭容器中,充分反应后放出0.5akJ的热量
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D为四种原子序数依次增大的短周期元素,其中B、C、D位于同一周期,A、B形成的分子具有对称的正四面体结构,C的单质分子是NO+(亚硝酰离子)的等电子体,D是元素周期表中电负性最大的元素。根据上述,回答下列问题:
⑴B原子的核外电子排布式是______________;
⑵写出上述A、B所形成的分子的电子式:____________;
⑶NO+的结构中可能含____个σ键,含___个π键。
⑷写出B、C的氢化物的立体构型分别是________、_________;
⑸用氢键表示式写出D的氢化物溶液中存在的所有氢键______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】油酸甘油酯和硬脂酸甘油酯均是天然油脂的成分。 它们的结构简式如下图所示。

下列说法错误的是
A. 油酸的分子式为C18H34O2
B. 硬脂酸甘油酯的一氯代物共有54种
C. 天然油脂都能在NaOH溶液中发生取代反应
D. 将油酸甘油酯氢化为硬脂酸甘油酯可延长保存时间
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com