
科目: 来源: 题型:
【题目】常温下,将pH均为11,体积均为V0的AOH和BOH溶液,分别加水稀释至体积V,pH随lg ![]() 的变化如图所示。下列说法不正确的是
的变化如图所示。下列说法不正确的是
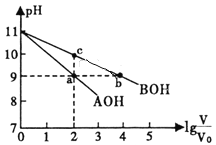
A. 碱性强弱:AOH>BOH
B. 水的电离程度:a=b>c
C. 稀释相同倍数时:c(A+)<c(B+)
D. 中和盐酸的能力:a=b<c
查看答案和解析>>
科目: 来源: 题型:
【题目】已知常温下二氯化二硫(S2 Cl2)为红棕色液体,其结构式为Cl-S-S-Cl。其制备反应及与水反应的化学方程式如下:①CS2+3Cl2 ![]() CCl4+S2Cl2 ②2S2Cl2 +2H2O=4HCl+SO2↑+3S↓则下列说法正确的是 ( )
CCl4+S2Cl2 ②2S2Cl2 +2H2O=4HCl+SO2↑+3S↓则下列说法正确的是 ( )
A. 反应①中CS2作氧化剂
B. 反应②中S2Cl2既作氧化剂又作还原剂
C. 反应①中每生成1mol S2Cl2转移4mol电子
D. 反应②中氧化产物与还原产物的物质的量之比为3:1
查看答案和解析>>
科目: 来源: 题型:
【题目】焦炭催化还原二氧化硫的化学方程式为2C(s)+2SO2(g) ![]() S2(g)+2CO2(g)。一定压强下,向1L密闭容器中充入足量的焦炭和1molSO2发生反应,测得SO2的生成速率与S2(g)的生成速率随温度变化的关系如图所示,下列说法正确的是
S2(g)+2CO2(g)。一定压强下,向1L密闭容器中充入足量的焦炭和1molSO2发生反应,测得SO2的生成速率与S2(g)的生成速率随温度变化的关系如图所示,下列说法正确的是

A. 该反应的H>0B. C点时达到平衡状态
C. 增加C的量能够增大SO2的转化率D. T3时增大压强,能增大活化分子百分数
查看答案和解析>>
科目: 来源: 题型:
【题目】H2S与CO2在高温下发生反应:CO2 (g) + H2S (g) ![]() COS (g) + H2O (g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。下列说法不正确的是
COS (g) + H2O (g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。下列说法不正确的是
A. 升高温度,H2S浓度增加,表明该反应是放热反应
B. 通入CO2后,正反应速率先增大后减小
C. H2S的平衡转化率α = 4.5 %
D. 反应平衡常数K = 1/351
查看答案和解析>>
科目: 来源: 题型:
【题目】印刷铜制电路板的腐蚀液选取和回收再利用一直是研究的热点。
(1)应用传统蚀刻液(HCl-FeCl3)
①蚀刻铜板主要反应的离子方程式为_____。
②腐蚀结束后,通过以下两步可分离出铜,并实现FeCl3溶液再生。
![]()
步骤I所加试剂和操作分别为______。可实现步骤II转化的物质或方法是____(填一种即可)。
(2)应用酸性蚀刻液(HCl-H2O2),产生的蚀刻废液处理方法如图:
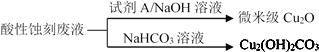
①蚀刻铜板主要反应的离子方程式为_____。
②回收微米级Cu2O过程中,加入的试剂A是____(填字母)。
a.Fe粉 b.葡萄糖 c. NaCl固体 d.酸性KMnO4溶液
③回收Cu2(OH)2CO3的过程中需控制反应的温度,当温度高于80℃时,产品颜色发暗,其原因可能是_____。
(3)应用碱性蚀刻液(NH3H2O–NH4Cl) 蚀刻铜板,会有Cu(NH3)4Cl2和水生成。蚀刻铜板主要反应的化学方程式为____。
查看答案和解析>>
科目: 来源: 题型:
【题目】铍铜是力学、化学综合性能良好的合金,广泛应用于制造高级弹性元件。以下是从某废旧铍铜元件(含BeO25%、CuS71%、少量FeS和SiO2)中回收铍和铜两种金属的流程。
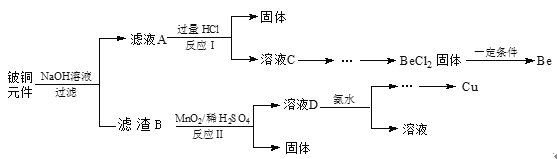
已知:I.铍、铝元素处于周期表中的对角线位置,化学性质相似。
(1)氢氧化铍的电离方程式为____。
(2)滤液A的主要成分除NaOH外,还有____(填化学式),写出反应I中含铍化合物与过量盐酸反应的离子方程____。
(3)①溶液C中含NaCl、BeCl2和少量HCl,为提纯BeCl2,选择合理步骤并排序_____。
a.加入过量的 NaOH b.通入过量的CO2 c.加入过量的氨水
d.加入适量的HCl e.过滤 f.洗涤
②从BeCl2溶液中得到BeCl2固体的操作是_____。
(4)①MnO2能将金属硫化物中的硫元素氧化为单质硫,写出反应Ⅱ中CuS发生反应的化学方程式______。
②若用浓HNO3溶解金属硫化物,缺点是______(任写一条)。
(5)取铍铜元件1000g,最终获得Be的质量为81g,则产率是______。
查看答案和解析>>
科目: 来源: 题型:
【题目】亚硫酰氯(俗称氯化亚砜,SOCl2)是一种液态化合物,沸点77℃,在农药、制药行业、有机合成等领域用途广泛。SOCl2遇水剧烈反应,液面上产生白雾,并常有刺激性气味的气体产生,实验室合成原理:SO2+Cl2+SCl2=2SOCl2,部分装置如图所示:
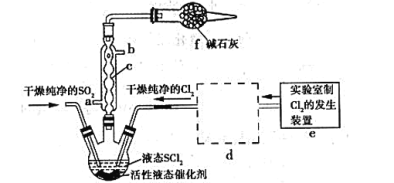
请回答下列问题:
(1)装置f的作用是_____。
(2)实验室用二氧化锰制备Cl2的离子方程式为_____。
(3)SOCl2遇水剧烈反应,液面上产生白雾,并伴有刺激性气味的气体,写出有关反应的化学方程式_____。
(4)下列制备SO2的原理中最佳选择是____。
A.Cu与浓硫酸混合共热
B.Na2S2O3溶液与稀硫酸混合反应
C.Na2SO3固体与70%的H2SO4混合反应
D.Na2SO3固体与4mol·L﹣1的HNO3混合反应
(5)装置e中产生的Cl2经过装置d后进入三颈烧瓶,d中所用的试剂为___。(按气流方向)
(6)若反应中消耗Cl2的体积为672mL(己转化为标准状况,SO2足量),最后得到纯净的SOCl2 4.76g,则SOCl2的产率为____(保留三位有效数字)。
(7)实验结束后,将三颈烧瓶中混合物分离开的实验操作是____(己知SCl2的沸点为50℃)。分离产物后,向获得的SOCl2中加入足量NaOH溶液,振荡、静置得到无色溶液W,检验溶液W中存在Cl-的方法是____。
查看答案和解析>>
科目: 来源: 题型:
【题目】雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生。根据题意完成下列填空:
(1)As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体。若As2S3和SnCl2正好完全反应,As2S3和SnCl2的物质的量之比为____。
(2)上述反应中的氧化剂是____,反应产生的气体可用_____吸收。
(3)As2S3和HNO3有如下反应:As2S3+10H++10NO3-=2H3AsO4+3S+10NO2↑+2H2O,若生成2mol H3AsO4,则反应中转移电子的数目为____。
(4)若反应产物NO2与11.2LO2(标准状况)混合后用水吸收全部转化成浓HNO3,然后与过量的碳反应,所产生的CO2的量___(填字母)。
A.小于0.5mol B.等于0.5mol C.大于0.5mol D.无法确
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法中正确的是
A. 25 ℃时0.1molL﹣1NH4Cl溶液的Kw大于100℃时0.01molL﹣1NaCl溶液的Kw
B. 常温下,pH均为3的醋酸和硫酸铝两种溶液中,由水电离出的氢离子浓度之比为1∶108
C. 根据溶液的pH与酸碱性的关系,推出pH=6.5的溶液一定显酸性
D. 室温下,将pH=2的盐酸与pH=12的氨水等体积混合,溶液显中性
查看答案和解析>>
科目: 来源: 题型:
【题目】一种具有高能量比的新型干电池示意图如图所示,石墨电极区发生的电极反应为MnO2+e-+H2O=MnO(OH)+OH-。该装置工作时,下列叙述正确的是

A. 石墨电极上的电势比Al电极上的低
B. Al电极区的电极反应式:A1-3e-+3NH3·H2O=Al(OH)3+3NH4+
C. 每消耗27gAl,有3mol电子通过溶液转移到石墨电极上
D. 若采用食盐水+NaOH溶液作电解质溶液,电极反应式相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com