
科目: 来源: 题型:
【题目】实验发现,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。现有一定量的铝粉和铁粉的混合物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中逐滴加入5mol/L NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示,下列说法不正确的是( )
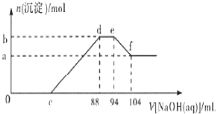
A.稀硝酸与铝粉、铁粉反应,其还原产物为硝酸铵
B.c点对应NaOH溶液的体积为48 mL
C.b点与a点的差值为0.05 mol
D.样品中铝粉和铁粉的物质的量之比为5:3
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是A、B、C、D、E五种有机物的有关信息
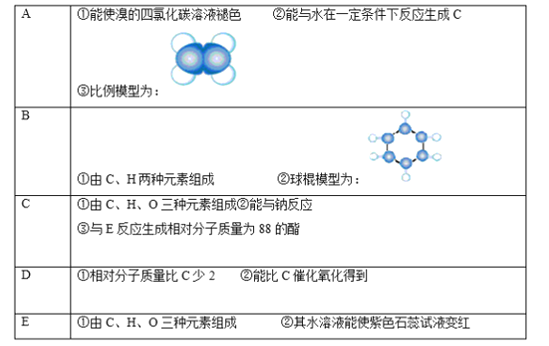
回答下列问题:
(1)A~E中,属于烃的是___________ (填字母)。
(2)A能使溴的四氯化碳溶液褪色,发生反应的化学方程式为 __________
(3)C和E生成的酯在碱性(氢氧化钠溶液)条件下水解的化学方程式为 _______
(4)有机物B具有的性质是________________(填序号)。
①无色无味的液体;②有毒;③不溶于水;④密度比水大;⑤能使酸性KMnO4溶液和溴水褪色
(5)E的水溶液能使紫色石蕊试液变红,说明E的水溶液显酸性,现设计一个实验来比较E与碳酸酸性的强弱,则该实验的原理是 _____(用化学方程式说明)。
查看答案和解析>>
科目: 来源: 题型:
【题目】I.实验室用下图甲所示的装置制取乙酸乙酯。
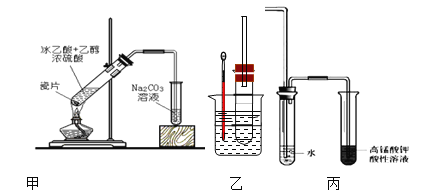
(1)饱和碳酸钠溶液的作用是:①_____ ;②________;③ ______
(2)右边装置中通蒸气的导管要插在液面上而不能插入溶液中,目的是防止_________
(3)分离得到乙酸乙酯的方法是_________ ,分离需要的玻璃仪器是 _________
(4)在制备乙酸乙酯实验中通常使用过量的乙醇目的是____________
II溴乙烷在不同溶剂中与NaOH可发生不同类型的反应,生成不同的反应产物。某同学依据溴乙烷的性质,用图实验装置(铁架台、酒精灯略)验证取代反应和消去反应的产物,请你一起参与探究。
(1)图乙在试管中加入5 mL 1 mol/L NaOH水溶液和5 mL 溴乙烷,
①水浴加热,优点是_________ 试管口安装一长导管的作用是___________
②鉴定生成物中乙醇的结构,可用的波谱是_______ 和 __________
(2)图乙在试管中加入5 mL NaOH乙醇溶液和5 mL 溴乙烷,水浴加热。
①请写出该反应的化学方程式______________
②为证明溴乙烷在NaOH乙醇溶液中发生的是消去反应,在设计的实验方案中,需要检验的是____,检验的装置如图丙所示,在气体通入酸性高锰酸钾溶液前加一个盛水的试管,其作用是____
查看答案和解析>>
科目: 来源: 题型:
【题目】NA表示阿伏加德罗常数的值,下列叙述正确的是
A. 18 g D2O所含的电子数为10NA
B. 1 mol H2O2中含有极性键的数目为3NA
C. 标准状况下,22.4 L四氯化碳所含分子数为NA
D. 32g O2和O3的混合物中含有的氧原子数为2NA
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述正确的是
A.SiO2 既能和NaOH 溶液反应,又能和氢氟酸反应,所以SiO2属于两性氧化物
B.因为Na2CO3+SiO2![]() Na2SiO3+CO2↑,所以硅酸的酸性比碳酸强
Na2SiO3+CO2↑,所以硅酸的酸性比碳酸强
C.因为2C+SiO2![]() Si+2CO↑,所以非金属性C>Si
Si+2CO↑,所以非金属性C>Si
D.晶体硅可用作太阳能电池板或半导体材料,二氧化硅可做光导纤维
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下将NaOH溶液滴加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是( )
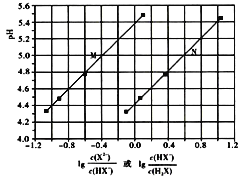
A.Ka2(H2X)的数量级为10-6
B.曲线N表示pH与lg![]() 的变化关系
的变化关系
C.NaHX溶液中c(H+)>c(OH-)
D.当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(H+)=c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列图示与对应的叙述符合的是

A. 用甲实线、虚线分别表示某可逆反应未使用催化剂和使用催化剂的正、逆反应速率随时间的变化
B. 图乙表示反应2SO2(g)+O2(g)![]() 2SO3(g)△H<0的平衡常数K与温度和压强的关系
2SO3(g)△H<0的平衡常数K与温度和压强的关系
C. 图丙表示向0.1mol/L的NH4Cl溶液中滴加0.1mol/L的HCl溶液时,溶液中![]() 随HCl溶液体积变化关系
随HCl溶液体积变化关系
D. 图丁表示常温下向20mL pH=3的醋酸中滴加pH=11的NaOH溶液,溶液的pH随NaOH溶液体积的变化关系
查看答案和解析>>
科目: 来源: 题型:
【题目】如图A~J分别代表相关反应中的一种物质,已知A分解得到等物质的量的B、C、D,常温下B、D为气态化合物,C为液态化合物,图中有部分生成物未标出。已知﹕2Mg+CO2![]() 2MgO+C。
2MgO+C。
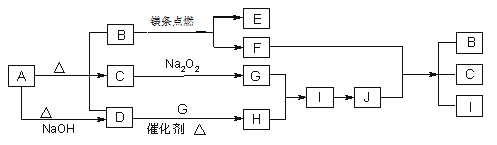
请回答下列问题:
(1)写出A的化学式:___。
(2)写出下列反应的化学方程式:
D+G→H___。
F+J→B+C+I___。
(3)写出A+NaOH→D的离子方程式___。
查看答案和解析>>
科目: 来源: 题型:
【题目】在半导体工业中有这样一句话:“从沙滩到用户”,其中由粗硅制纯硅的常用方法为:Si(粗)+2Cl2=SiCl4SiCl4+2H2=Si(纯)+4HCl。
若在25℃、101kPa条件下反应生成HCl气体49L,(注:25℃、101kPa条件下气体摩尔体积为24.5Lmol-1)则:
(1)反应生成HCl气体的质量为__,转移电子的总数为___。
(2)反应生成的HCl气体溶于127mL水中,得到密度为1.20gmL-1的盐酸,此盐酸的物质的量浓度为___。
(3)“从沙滩到用户”涉及多个反应,其中制取粗硅的反应方程式为___。纯净的石英与烧碱反应可以制得水玻璃,反应的离子方程式为__。
(4)普通玻璃若以氧化物形式表示其组成为(质量分数):Na2O13%,CaO11.7%,SiO275.3%。现以石灰石、纯碱和石英为原料生产这种玻璃10t,石灰石的利用率为80%,纯碱和石英的利用率为95%,至少需耍上述原料的质量是___t。(保留两位小数)
查看答案和解析>>
科目: 来源: 题型:
【题目】铜是重要的工业原料,现有![]() 、
、![]() 组成的混合物,某研究性学习小组为了探究其组成情况,取
组成的混合物,某研究性学习小组为了探究其组成情况,取![]() 该混合物加入
该混合物加入![]() 的稀硝酸中,固体物质完全反应,生成
的稀硝酸中,固体物质完全反应,生成![]() (标准状况)的
(标准状况)的![]() 。向所得溶液中加入
。向所得溶液中加入![]() 的
的![]() 溶液,恰好使溶液中的
溶液,恰好使溶液中的![]() 沉淀完全。
沉淀完全。
(1)![]() 与稀硝酸反应的化学方程式为____________。
与稀硝酸反应的化学方程式为____________。
(2)混合物中,![]() ______;
______;![]() ________。
________。
(3)![]() ______
______
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com