
科目: 来源: 题型:
【题目】X、Y、Z、W是四种短周期主族元素,X原子最外层上的电子数是原子核外电子层数的2倍;Y 原子最外层电子数是次外层电子数的2倍;Z元素的单质为双原子分子;Z的氢化物能与其最高价氧化物的水化物形成盐;W元素最高正价是+7价。回答下列问题:
(1)元素X原子结构示意图为________________,其周期表中的位置为__________。
(2)元素Y的一种同位素可测定文物年代,这种同位素的符号是______________。
(3)元素W的单质与元素X的低价氧化物在水溶液中反应的离子方程式为__________。
(4)ZW3可与水反应生成一种酸和一种碱,反应的化学方程式为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】I.髙锰酸钾在实验室和工农业生产中有广泛的用途,实验室以二氧化锰为主要原料制备高锰酸钾,其部分流程如下:

(1)第①步加热熔融应在铁坩埚中进行,而不用瓷坩埚的原因是_______________________________(用化学方程式表示)。
(2)第④步通人适量CO2,发生反应生成MnO4-、MnO2和碳酸盐,则发生反应的离子方程式为_______________________________。
(3)第⑥步加热浓缩至液面有细小晶体析出时,停止加热,冷却结晶、过滤、洗涤、干燥,干燥过程中,温度不宜过高,其原因是_________________(用化学方程式表)。
(4)H2O2和KMnO4都是常用的强氧化剂,若向H2O2溶液中滴加酸性髙锰酸钾溶液,则酸性髙锰酸钾溶液会褪色,写出该反应的离子方程式: ________________________________。
II.某小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究SO2和C12的性质。

(5)若从左端分别通入SO2和C12,装置A中观察到的现象是否相同______(填“相同”或“不相同”)。
(6)若装置B中装有5.0 mL 1.0 mol L-1的碘水,当通入足量Cl2完全反应后,共转移了5. 0×10-2 mol电子,则该反应的化学方程式为____________________________。
(7)若由元素S和O组成-2价酸根离子X,X中S和O的质量比为4 : 3;当Cl2与含有X的溶液完全反应后,有浅黄色沉淀产生,取上层清液加人氯化钡溶液,有白色沉淀产生。 写出Cl2与含有X的溶液反应的离子方程式: __________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】汽车在现代生活中扮演着越来越重要的角色,但其尾气(碳氢化合物、氮氧化物及一氧化碳等)带来的环境污染越来越明显,机动车废气排放已成为城市大气污染的重要来源。
(1)设汽油成分为C8H18,若在气缸中汽油高温裂解产生丁烷和丁烯,写出该反应的化学方程式____
(2)气缸中生成NO的反应为:N2(g)+O2(g) ![]() 2NO(g) △H >0
2NO(g) △H >0
①汽车启动后,气缸内温度越高,单位时间内NO排放量越大,原因是___________。
②1mol空气中含有0.8molN2和0.2molO2,1300℃时在含1mol空气的密闭容器内反应达到平衡。测得NO为8×10-4mol。计算该温度下的平衡常数K≈_____________。
(3)尾气中的CO主要来自于汽油不完全燃烧。
①有人设想按下列反应除去CO:2CO(g)=2C(s)+O2(g) △H=+221kJ·mol-1, 简述该设想能否实现的依据:______________。
②测量汽车尾气的浓度常用电化学气敏传感器,其中CO传感器可用下图简单表示,则阳极发生的电极反应为______。

(4)在汽车尾气系统中安装催化转换器,可有效减少尾气中的CO、NOx 和碳氢化合物等废气。
已知:N2(g)+O2(g)=2NO(g) △H1=+180kJ/mol
CO(g) +1/2O2(g)= CO2(g) △H2=-283kJ/mol
2NO(g)+ 2CO(g) = 2CO2(g) + N2(g) △H3
则△H3 =__________kJ·mol-1。
(5)光化学烟雾(含臭氧、醛类、过氧乙酰硝酸酯等)是汽车尾气在紫外线作用下发生光化学反应生成的二次污染物。写出2-丁烯与臭氧按物质的量之比为1:2反应生成乙醛及氧气的化学方程式____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知(Ⅰ)、(Ⅱ)反应在一定条件下焓变及平衡常数如下:
2H2(g)+S2(g)2H2S(g) ΔH1 K1 (Ⅰ)
3H2(g)+SO2(g)2H2O(g)+H2S(g) ΔH2 K2 (Ⅱ)
(1)用ΔH1、ΔH2表示反应4H2(g)+2SO2(g)=S2(g)+4H2O(g)的ΔH=________。
(2)回答下列反应(Ⅰ)的相关问题:
①温度为T1,在1 L恒容容器中加入1.8 mol H2、1.2 mol S2,10 min时反应达到平衡。测得10 min内v(H2S)=0.08 mol·L-1·min-1,则该条件下的平衡常数为________。
②温度为T2时(T2>T1),在1 L恒容容器中也加入1.8 mol H2、1.2 mol S2,建立平衡时测得S2的转化率为25%,据此判断ΔH1________0(填“>”或“<”),与T1时相比,平衡常数K1__(填“增大”“减小”或“不变”)。
(3)常温下,用SO2与NaOH溶液反应可得到NaHSO3、Na2SO3等。
①已知Na2SO3水溶液显碱性,原因是________________(写出主要反应的离子方程式),该溶液中,c(Na+)______2c(SO32-)+c(HSO3-)(填“>”“<”或“=”)。
②在某NaHSO3、Na2SO3混合溶液中HSO3-、SO32-物质的量分数随pH变化曲线如图所示(部分),根据图示,则SO32-的水解平衡常数=________。
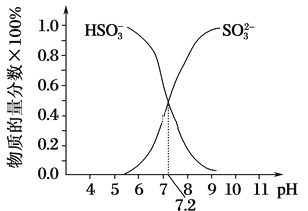
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.甲同学用含少量铁的氧化物的氧化铜制取氯化铜晶体(CuCl2·xH2O)并测量其结晶水含量。已知:在pH为4~5时,Fe3+几乎完全水解而沉淀,而此时Cu2+却几乎不水解。制取流程如下:

请回答下列问题:
(1)溶液A中的金属离子有Fe3+、Fe2+、Cu2+。能检验溶液A中Fe2+的试剂为________(填编号)。
①KMnO4 ②K3[Fe(CN)6] ③NaOH ④KSCN
(2)试剂①是________,试剂②是________。(填化学式)
(3)为了测定制得的氯化铜晶体(CuCl2·xH2O)中x的值,某兴趣小组设计了以下实验方案:
称取m g晶体溶于水,加入足量氢氧化钠溶液、过滤、沉淀洗涤后用小火加热至质量不再减轻为止,冷却,称量所得黑色固体的质量为n g。沉淀洗涤的操作方法是________,根据实验数据测得x=________(用含m、n的代数式表示)。
Ⅱ.乙同学设计了一套电解饱和食盐水的实验装置,来验证氯气的某些性质和测定产生的氢气的体积。
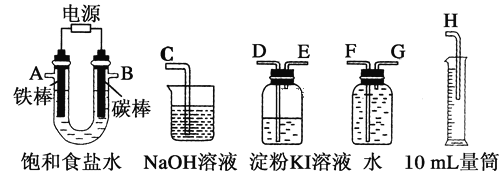
(4)所选仪器接口的连接顺序是A接________,________接________;B接________,________接________。
(5)若装入的饱和食盐水为75 mL(氯化钠足量,电解前后溶液体积变化可忽略,假设两极产生的气体全部逸出),当测得氢气为8.4 mL(已转换成标准状况下的体积)时停止通电。将U形管内的溶液倒入烧杯,常温时测得溶液的pH约为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定体积的密闭容器中进行如下化学反应:CO2(g)+H2(g) ![]() CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:
t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=________。
(2)该反应为________(填“吸热”或“放热”)反应,理由是__________。
(3)能判断该反应达到化学平衡状态的依据是________。
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O) D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为______℃。
(5)在800 ℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)为2 mol·L-1,c(H2)为1.5 mol·L-1,c(CO)为1 mol·L-1,c(H2O)为3 mol·L-1,则下一时刻,反应向_____(填“正向”或“逆向”)进行。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知X、Y是阳离子,Z是阴离子,M、N是分子,它们都由短周期元素组成,且具有以下结构特征和性质:
①X、Y、M、N的核外电子总数相等;②常温下,M是极易溶于N的气体;③X与M均由相同的元素组成;④Y为单核离子,其与Z组成的物质可用于净水;⑤Z由同主族元素组成。请回答下列问题:
(1)X的电子式为_______,Z的离子符号为_______。
(2)X与Z形成的化合物中所含有的化学键类型为_______。
(3)写出Y与M、N形成的混合物发生反应的离子方程式:_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得达到平衡时的有关数据如下[已知X(g)+3Y(g)![]() 2Z(g) ΔH=Q kJ·mol1]:
2Z(g) ΔH=Q kJ·mol1]:
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 1 mol X、3 mol Y | 2 mol Z | 4 mol Z |
Z的浓度(mol·L1) | c1 | c2 | c3 |
反应的能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
体系压强(Pa) | p1 | p2 | p3 |
反应物转化率 | α1 | α2 | α3 |
下列说法正确的是
A. 2c1>c3B. a+b=QC. 2p2<p3D. α1+α3>1
查看答案和解析>>
科目: 来源: 题型:
【题目】将E(g)和F(g)加入密闭容器中,在一定条件下发生反应:E(s)+4F(g)G(g),已知该反应的平衡常数如表所示。下列说法正确的是( )
温度/℃ | 25 | 80 | 230 |
平衡常数/(L3·mol-3) | 5×104 | 2 | 1.9×10-5 |
A.上述反应是熵增反应
B.25 ℃时,反应G(g)E(s)+4F(g)的平衡常数是0.5 mol3·L-3
C.在80 ℃时,测得某时刻,F、G的浓度均为0.5 mol·L-1,则此时v正>v逆
D.恒温恒容下,向容器中再充入少量G(g),达新平衡时,G的体积百分含量将增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com