
科目: 来源: 题型:
【题目】下列说法不正确的是
A.芳香烃是分子组成符合CnH2n-6(n≥6)的一类物质
B.苯和浓硝酸在55~60℃,浓硫酸存在时发生硝化反应
C.甲苯可以和浓硝酸与浓硫酸的混合物发生硝化反应
D.等质量的烃(CxHy)耗氧量取决于![]() 的值,越大则耗氧多
的值,越大则耗氧多
查看答案和解析>>
科目: 来源: 题型:
【题目】“84消毒液”因1984年北京某医院研制使用而得名,在日常生活中使用广泛,其有效成分是NaClO。某化学研究性学习小组在实验室制备NaClO溶液,并进行性质探究和成分测定
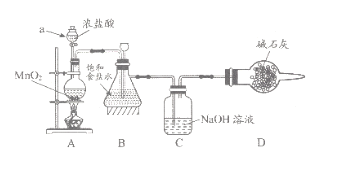
(1)该学习小组按上图装置进行实验(部分夹持装置省去),反应一段时间后,分别取B、C瓶中的溶液进行实验,实验现象如下表。
已知:1.饱和NaClO溶液pH为11;
2.25°C时,弱酸电离常数为:H2CO3:K1=4.4×10-7,K2=4.7×10-11;HClO:K=3×10-8
B瓶 | C瓶 | |
实验1:取样,滴加紫色石蕊试液 | 变红,不褪色 | 变蓝,不褪色 |
实验2:测定溶液的pH | 3 | 12 |
回答下列问题:
①仪器a的名称_____,装置A中发生反应的离子方程式________。
②实验1中B瓶溶液中产生现象的原因是_________。
③若将C瓶溶液换成 NaHCO3溶液,按上述操作步骤进行实验,C瓶现象为:实验1中紫色石蕊试液立即褪色;实验2中溶液的pH=7。结合平衡移动原理解释紫色石蕊试液立即褪色的原因______。
(2)测定C瓶溶液中NaClO含量(单位:g/L)的实验步骤如下:
Ⅰ.取C瓶溶液20ml于锥形瓶中,加入硫酸酸化,加入过量KI溶液,盖紧瓶塞并在暗处充分反应。
Ⅱ.用0.1000mol/LNa2S2O3标准溶液滴定锥形瓶中的溶液,指示剂显示终点后,重复操作2~3次,Na2S2O3溶液的平均用量为24.00ml。(已知:I2+2S2O32-=2I-+S4O62-)
①步骤Ⅰ的C瓶中发生反应的离子方程式为_______。
②步骤Ⅱ通常选用___作指示剂,滴定至终点的现象______。
③C瓶溶液中NaClO含量为_____g/L(保留2位小数)
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D为原子序数依次增大的前四周期元素。BA3能使湿润的红色石蕊试纸变蓝,A、B、C三种原子的电子数之和等于25,D有两种常见氧化物,其中一种颜色是砖红色的。
请回答下列问题:
(1)以上四种元素中,电负性最小的是____(填元素符号);
(2)在BA3、AC中,沸点较高的是____(填化学式),其原因是_____。
(3)B元素组成的常见单质中σ键和π键的个数比是____,D的基态原子的外围电子排布式为______。
(4)化合物BA3的立体构型为_____,其中心原子的杂化轨道类型为_______。
(5)由B、D形成的晶体的晶胞图所示,己知紧邻的B原子与D原子距离为acm。
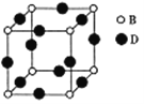
①该晶胞化学式为_____。
②该晶体的密度为_____gcm-3(用含a、NA的代数式表示,设NA为阿伏加德罗常数值)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解9.6g。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体)。下列分析或结果错误的是( )
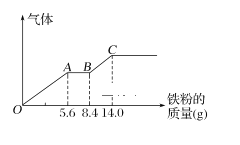
A. 原混合酸中NO3-物质的量为0.1 mol
B. OA段产生的气体是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生H2
C. 第二份溶液中最终溶质为FeSO4
D. H2SO4浓度为2.5 molL-1
查看答案和解析>>
科目: 来源: 题型:
【题目】室温时,向20mL 0.1mol/L的CH3COOH溶液中不断滴加0.1mol/L的NaOH溶液,溶液的pH变化曲线如图所示,在滴定过程中,下列关于溶液中离子浓度大小关系的描述不正确的是( )
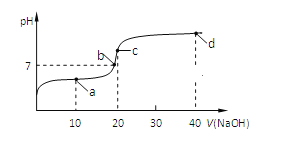
A. a点时:c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-)
B. b点时:c(Na+)<c(CH3COO-)
C. c点时:c(OH-)=c(CH3COOH)+ c(H+)
D. d点时:c(Na+)>c(OH-) > c(CH3COO-)>c(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】根据表中提供的数据,下列判断正确的是
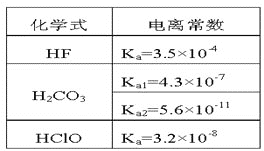
A.同温同浓度下,溶液的pH:NaF>NaClO>Na2CO3
B.结合H+的能力:ClO->CO32->F-
C.次氯酸钠溶液中通少量二氧化碳的离子方程式:ClO-+H2O+CO2=HClO+HCO3-
D.碳酸钠溶液中加入少量氢氟酸的离子方程式:CO32-+2HF=2F-+H2O+CO2↑
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下向10mLpH=3的醋酸溶液中加入水稀释后,下列说法正确的是
A.溶液中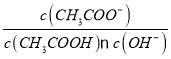 不变
不变
B.溶液中导电粒子的数目减少
C.醋酸的电离程度增大,c(H+)亦增大
D.完全致中和醋酸需加入10mLpH=11的NaOH溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】下列电极反应式或离子方程式与所述事实相符且正确的是( )
A. 用银作电极材料电解氯化铜溶液的阳极反应式:2Cl--2e- =Cl2↑
B. 甲烷碱性燃料电池的负极反应式:CH4 +10OH--8e- =CO32-+7H2O
C. 向FeBr2溶液中通入过量的Cl2:2Fe2++2Br-+2Cl2=2Fe3+ +Br2+4Cl-
D. 向NH4Al(SO4)2溶液中加入Ba(OH)2溶液至恰好使SO42-完全沉淀:Al3+ +2SO42-+2Ba2 ++4OH-=AlO2-+2BaSO4↓+2H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】NH3是一种重要的化工原料,在生产、生活中用途广泛。
(1)已知:
共价键 | 键能/ kJ·mol-1 |
H―H | 436 |
N≡N | 946 |
N―H | 391 |
注:拆开气态物质中1 mol某种共价键需要吸收的能量,就是该共价键的键能。
N2 (g)+3 H2 (g)![]() 2 NH3 (g) H =____kJ·mol-1
2 NH3 (g) H =____kJ·mol-1
(2)一定温度下,向恒容的密闭容器中充入N2和H2发生反应:N2 +3H2 ![]() 2NH3,测得各组分浓度随时间变化如图1所示。
2NH3,测得各组分浓度随时间变化如图1所示。
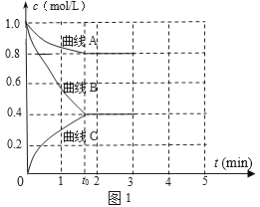
①表示c(N2)的曲线是__(填“曲线A”、“曲线B”或“曲线C”)。
②0~t0时用H2表示反应速率v(H2)____mol·L-1·min-1。
③下列能说明该反应达到平衡的是____。
a.混合气体的压强不再变化
b.2c(H2)= 3c(NH3)
c.混合气体的质量不再变化
d.NH3的体积分数不再变化
(3)潜艇中使用的液氨-液氧燃料电池工作原理如图2所示:
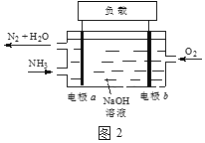
①电极b名称是____。
②电解质溶液中OH-离子向____移动(填“电极a”或“电极b”)。
③电极a的电极反应式为____。
(4)可通过NH3与NaClO反应来制得火箭燃料肼(N2H4)。该反应的化学反应方程式是____。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)在一个小烧杯中加入20g Ba(OH)2·8H2O晶体和10gNH4Cl晶体,然后将小烧杯放在事先滴有3滴~4滴水的玻璃片上,立即用玻璃棒搅拌。实验过程的示意图如下:
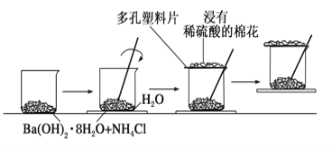
①实验中玻璃棒的作用是:_________。
②浸有稀硫酸的棉花的作用是:_________。
③出现_________现象时,说明该反应为吸热反应。
(2)沼气是一种廉价能源,农村存在大量的秸秆、杂草等废弃物,它们经微生物发酵之后,便可产生沼气,其主要成分是甲烷,可用来点火做饭。在农村推广建造沼气池,不仅能有效地利用_______能,还能为农业生产提供优良的肥料。已知:标准状况下112.0L CH4气体完全燃烧生成CO2和液态水时,放出4448kJ的热量。
①写出CH4完全燃烧的热化学方程式为:_________。
②如果上述反应生成的是水蒸气,则反应放出的热量:______4448kJ。(填“>”或“<”或“=”)
(3)钢铁在发生电化学腐蚀时钢铁中少量的碳作为原电池的______极,正极发生的电极反应式为:__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com