
科目: 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的前四周期元素。其中X是形成化合物种类最多的元素,Y原子基态时2p原子轨道上有3个未成对的电子,Z单质占空气体积的![]() ,W的内层电子全充满,最外层只有1个电子。请回答下列问题:
,W的内层电子全充满,最外层只有1个电子。请回答下列问题:
(1)X、Y、Z的电负性从大到小的顺序是___ (用元素符号表示,下同),三种元素的第一电离能由大到小的顺序为______。
(2)写出X的电子排布式_____。
(3)W同周期的元素中,与W原子最外层电子数相等的元素还有_____。
(4)X、Y、Z的简单氢化物的键角从大到小的顺序是____(用化学式表示),原因是_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列叙述正确的是
A.常温常压下,1.06g Na2CO3含有的Na+离子数目为0.02 NA
B.常温常压下,2NA个CO2分子占有的体积为44.8L
C.标准状况下,22.4LH2O含有的分子数为 NA
D.物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为 NA
查看答案和解析>>
科目: 来源: 题型:
【题目】随原子序数的递增,八种短周期元素的原子半径的相对大小、最高正价或最低负价的变化如下图所示,下列分析正确的是( )
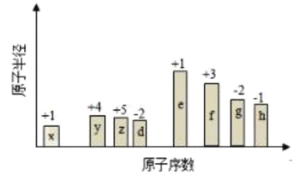
A.![]() 、
、![]() 的简单离子半径大小:
的简单离子半径大小:![]()
B.元素的金属性:![]()
C.元素的非金属性:![]()
D.![]() 、
、![]() 、
、![]() 和
和![]() 四种元素能形成离子化合物
四种元素能形成离子化合物
查看答案和解析>>
科目: 来源: 题型:
【题目】36.5 g氯化氢溶解在1 L水中(水的密度近似为1 g/mL),所得溶液的密度为ρ g/mL,质量分数为m,物质的量浓度为c mol/L,NA表示阿伏加德罗常数的值,则下列叙述正确的是( )
A.所得溶液的物质的量浓度为1mol/L
B.36.5 g氯化氢含有NA个原子
C.36.5 g HCl气体占有的体积为22.4 L
D.所得溶液的质量分数为=![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】表格中如图是乙醇分子的化学键断键位置的示意图。下列对乙醇发生反应时的反应条件、断键方式及主要有机产物的叙述中错误的是( )
选项 | 反应条件 | 断键位置 | 主要有机产物 | 乙醇的分子结构 |
A.与钠反应 | 常温 | ① | CH3CH2ONa |
|
B.催化氧化 | Cu或Ag | ②③ | CH3COOH | |
C.消除反应 | 浓硫酸,170℃ | ③④ | CH2=CH2 | |
D.与HBr反应 | △ | ② | CH3CH2ONa |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】下表为周期表的一部分,其中的编号代表对应的元素。
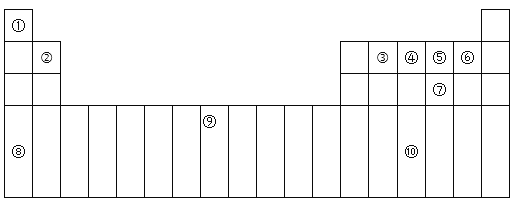
(1)在①~⑩元素的电负性最大的是:_____(填化学式)。
(2)⑨元素有____种运动状态不同的电子。
(3)⑩的基态原子的价电子排布式为:_________。
(4)⑤的氢化物与⑦的氢化物比较稳定的是:___,沸点较高的是:____(填化学式)。
(5)元素⑦和⑧形成的化合物属于____晶体,它比Na2O的熔点____(填“高”或“低”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,恒容密闭容器中发生N2(g)+3H2(g)![]() 2NH3(g)反应,反应速率与反应时间的关系如图所示。对两种平衡状态下各物理量的比较错误的是( )
2NH3(g)反应,反应速率与反应时间的关系如图所示。对两种平衡状态下各物理量的比较错误的是( )
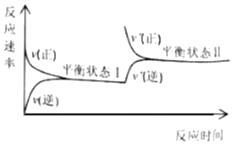
A.平衡状态Ⅱ时的c(H2)一定小B.平衡状态Ⅱ时的c(NH3)一定大
C.平衡常数K一样大D.平衡状态Ⅱ时的v(正)一定大
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于晶体的说法一定正确的是( )

CaTiO3晶体的结构模型
A. 分子晶体中都存在共价键
B. 金属晶体的熔点都比分子晶体的熔点高
C. CaTiO3晶体中每个Ti4+和12个O2-相紧邻
D. SiO2晶体中每个硅原子与两个氧原子以共价键相结合
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E、 F、G、H是周期表中前四周期的七种元素,有关性质或结构信息如下表:
元素 | 有关性质或结构信息 |
A | 地壳中含量最多的元素 |
B | B阳离子与A阴离子电子数相同,且是所在周期中单核离子半径最小的 |
C | C与B同周期,且是所在周期中原子半径最大的(稀有气体除外) |
D | D原子最外层电子数是电子层数的2倍,其氢化物有臭鸡蛋气味 |
E | E与D同周期,且在该周期中原子半径最小 |
F | F的氢化物和最高价氧化物的水化物反应生成一种离子化合物 |
G | G是形成化合物种类最多的元素 |
H | H是与D相邻的同主族元素,且原子半径:H>D |
(1) B元素符号为________ ,A与C以原子个数比为1:1形成的化合物的电子式为_______ ,用电子式表示C与E形成化合物的过程________ 。
(2) A、C、E所形成简单离子半径由大到小的顺序是____________ ,H的最高价氧化物对应水化物的化学式为_________ ,A、D、H的氢化物的沸点由高到低的顺序为____________________ 。
(3) 非金属性D_________ E(填“大于”或“小于”)。下列事实能证明这一结论的是________ (选填字母序号)。
a.E的熔点低于D
b.氢化物的还原性:D > E
c.最高价氧化物对应的水化物酸性:E > D
d.氢化物的酸性:E >D
查看答案和解析>>
科目: 来源: 题型:
【题目】以下是某工厂的生产流程:
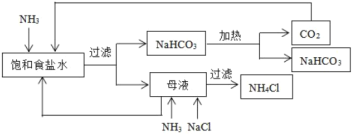
下列分析正确的是( )
A.母液中只含有:NH3和CO2B.母液中只含有:NH4+和Cl-
C.向母液中通NH3、加NaCl时加热D.该工厂的产品是纯碱和NH4Cl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com