
科目: 来源: 题型:
【题目】现有下列十种物质:①液态氯化氢;②小苏打;③固体纯碱;④二氧化碳;⑤葡萄糖;⑥氢氧化钾;⑦氢氧化铁胶体;⑧氨水;⑨空气;⑩硫酸铁溶液。
(1)上述十种物质中,属于电解质的___________,属于非电解质的有____________。
(2)有两种物质在水溶液中可发生反应,离子方程式为:H+ + OH- = H2O,该反应的化学方程式为________。
(3)除去③中少量②的操作是___________,化学方程式为__________。
(4)现有10mL⑩溶液中含Fe3+ 5.6g,则溶液中SO42-的物质的量浓度是____________。
(5)若在⑦中缓慢加入①的水溶液,产生的现象是_____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】镓是制作高性能半导体的重要原料。工业上常从锌矿冶炼的废渣中回收镓。已知某锌矿渣主要含Zn、Si、Pb、Fe、Ga的氧化物,利用该矿渣制镓的工艺流程如下: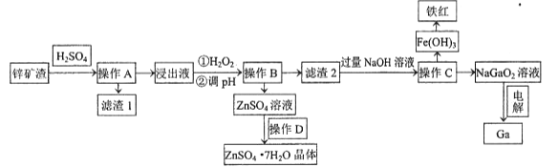
已知:①镓在元素周期表中位于第四周期第ⅢA族,化学性质与铝相似。
②lg2=0.3 lg3=0.48。
③部分物质的Ksp如下表所示。
物质 | Zn(OH)2 | Ga(OH)3 | Fe(OH)2 | Fe(OH)3 |
Ksp | 1.6×10-17 | 2.7×10-31 | 8×10-16 | 2.8×10-39 |
(1)为了提高酸浸速率,除适当增加硫酸浓度外,应采取的措施有__________________(写出两条)。滤渣1的主要成分是硫酸铅及_________________(写化学式)。
(2)加入H2O2的目的是(用离子方程式表示)______________________ 。
(3)室温条件下,若浸出液中各阳离子的浓度均为0.01mo/L,当溶液中某种离子浓度小于1×10-5mol/L时即认为该离子已完全除去,则pH应调节的范围为___________________。
(4)操作D包括:_______________过滤、洗涤、干燥。
(5)电解法制备金属镓。用惰性电极电解NaGaO2溶液即可制得金属镓,写出阴极电极反应式________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有X、Y、Z三种常见短周期元素,X 的原子结构示意图为![]() ,Y、Z为同周期金属元素,Y、Z的最高价氧化物对应水化物可以反应生成盐和水。回答下列问题:
,Y、Z为同周期金属元素,Y、Z的最高价氧化物对应水化物可以反应生成盐和水。回答下列问题:
(1)已知Y2X2为浅黄色固体物质,其阴阳离子个数比为_______,其中含有的化学键类型有_________。
(2)将单质 Z 的薄片在酒精灯上加热至熔化,观察到的现象是___________,产生该现象的原因是___________。
(3)Y、Z最高价氧化物对应的水化物混合反应生成盐和水的离子方程式为____________________。
(4)若(3)中生成物还可表示为YZ(OH)4,则YZ(OH)4与过量HC1溶液反应的离子方程式为_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】无水氯化铝是有机合成工业中一种重要的催化剂,工业上由Al2O3制备无水氯化铝的反应为2Al2O3+6Cl2![]() 4AlCl3+3O2。
4AlCl3+3O2。
(1)实验室制氯气的离子方程式为_________________________氯气溶于水生成的次氯酸的电子式为__________________________
(2)AlCl3可以作净水剂,其原理是(用离子方程式表示) ___________________________
(3)Al-Mg合金焊接前用NaOH溶液处理Al2O3膜,其离子方程式为________________
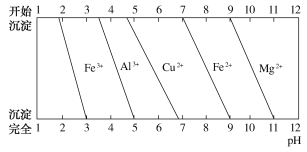
(4)为分析某铝合金的成分,用足量稀硝酸将其完全溶解后,用NaOH溶液调pH,当pH=3.4时开始出现沉淀,分别在pH为5、9时过滤沉淀,继续滴加NaOH溶液无沉淀生成。结合图象信息推断该合金中除铝外还含有的金属是___________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某溶液中可能含有H+、Na+、NH4+、Fe3+、Al3+、SO42-等离子。向该溶液中滴加NaOH溶液,生成沉淀的物质的量变化曲线如图所示。下列有关判断正确的是 ( )
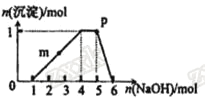
A.m点处反应:H++OH-=H2O
B.p点:c(OH-)>c(NH4+)>c(H+)
C.若取原溶液做焰色反应实验,焰色应为黄色
D.原溶液中存在的主要离子:n(H+)=2n(NH4+)=n(Al3+)
查看答案和解析>>
科目: 来源: 题型:
【题目】用如图实验装置探究铜丝与过量浓硫酸的反应及SO2的部分化学性质。
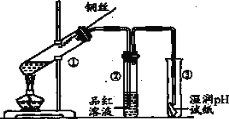
(1)试管①中发生反应的化学反应方程式为_____________________。
(2)装置③证明SO2溶液显__________性,同时证明SO2_________(填“能”或“不能”)漂白pH试纸。
(3)实验完毕,取下试管②并加热,可观察的现象是____________,该实验可以达到的目的是_______。
(4)实验初期发现大试管内有白色沉淀生成,该沉淀的化学式为_____________。
(5)终止试管①中反应的方法是_____________。
(6)基于环境保护的考虑,如图是某学生提出的实验改进方法,其中棉花团上应浸取的试剂为_________(任填一种)。
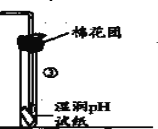
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A. 17 g H2O2与17 g H2S所含的电子数均为9NA
B. 密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA
C. 0.1 mol Cl2通入适量水中,转移电子数为0.2NA
D. 2 L pH =3的醋酸与足量的锌反应,产生H2分子数为10-3 NA
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验的反应原理用离子方程式表示正确的是( )
A. 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2![]() 2Mn2++5O2↑+8H2O
2Mn2++5O2↑+8H2O
B. 用氢氧化钠溶液除去镁粉中的杂质铝:2Al+2OH-![]() 2AlO2-+H2↑
2AlO2-+H2↑
C. 室温下测得氯化铵溶液pH<7,证明一水合氨是弱碱:NH4++2H2O![]() NH3·H2O+H3O+
NH3·H2O+H3O+
D. 用酸性高锰酸钾标准溶液滴定草酸:2MnO4-+16H++5C2O42-![]() 2Mn2++10CO2↑+8H2O
2Mn2++10CO2↑+8H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】A在一定温度下有分解反应A (s) = B(s) + C(g) + 4D(g),若测得生成的气体的质量是同温压下,相同体积氢气的10倍,且当所生成的气体在标况下的体积为22.4L时,所得B的质量为30.4g,A的摩尔质量为( )
A.120.4g/molB.50.4g/molC.182.4g/molD.252g/mol
查看答案和解析>>
科目: 来源: 题型:
【题目】下列化学反应中,既是离子反应,又是氧化还原反应的是( )
A.2NaOH + H2SO4 = Na2SO4 + 2H2OB.Fe + H2SO4 = FeSO4 + H2↑
C.BaCl2 + H2SO4 = BaSO4↓+ 2HClD.H2 + CuO![]() Cu+H2O
Cu+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com