
科目: 来源: 题型:
【题目】已知甲、乙、丙三种物质均含有同种元素X,其转化关系如下:
![]()
下列说法错误的是
A.若A为NaOH溶液,乙为白色沉淀,则X可能为短周期金属元素
B.若A为硝酸,X为金属元素,则甲与乙反应可生成丙
C.若A为氧气,丙在通常状况下为红棕色气体,则甲可能为非金属单质
D.若乙为NaHCO3,则甲或丙可能是CO2
查看答案和解析>>
科目: 来源: 题型:
【题目】已知 4NH3+5O2 = 4NO+6H2O(g),若反应速率分别用 v(NH3)、v(O2)、v(NO)、v(H2O)表示,则正确的关系是( )
A.v(O2)=![]() v(NH3)B.v(H2O)=
v(NH3)B.v(H2O)= ![]() v(O2)C.v(H2O)=
v(O2)C.v(H2O)=![]() v(NH3)D.v(NO)=
v(NH3)D.v(NO)= ![]() v(O2)
v(O2)
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示是短周期的一部分,已知B原子与C 原子核外电子总数之和为A的4倍,则下列推断正确的是

A.A、B、C三者中,A为金属性元素,B、C为非金属性元素
B.A、B、C三者核电荷数之和为40
C.A与B、A与C均可形成离子化合物
D.B与C只能形成一种共价化合物
查看答案和解析>>
科目: 来源: 题型:
【题目】由SO2和O2制备SO3(熔点16.8 ℃,沸点44.8 ℃)的模拟装置如图所示(加热和夹持装置省略):
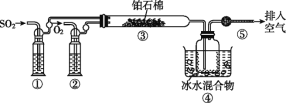
下列说法正确的是( )
A.装置①中的试剂为饱和NaHSO3溶液
B.实验室可用铜与浓硫酸在常温条件下制取SO2
C.装置③反应管中的铂石棉用作反应的催化剂
D.从装置⑤逸出的气体有过量的SO2和O2
查看答案和解析>>
科目: 来源: 题型:
【题目】在100 mL FeBr2溶液中通入标准状况下2.24 L Cl2,溶液中有![]() 的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为( )
的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为( )
A.4 mol L-1B.![]() mol L-1C.
mol L-1C.![]() mol L-1D.
mol L-1D.![]() mol L-1
mol L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室要配制480 mL 0.2 mol/L HCl溶液,请回答下列问题:
(1)配制溶液时的步骤有:①计算 ②溶解 ③洗涤 ④(恢复室温后)移液 ⑤定容 ⑥摇匀 ⑦称量,正确的顺序是___________。
A. ①②③④⑤⑥⑦ B. ①⑦②④③⑤⑥ C. ①⑦②④③⑥⑤
(2)配制过程中不需要使用的化学仪器有____________(填选项的字母)。
A. 烧杯 B. 500 mL容量瓶 C. 漏斗 D. 胶头滴管 E. 玻璃棒
(3)从所配HCl溶液中取出10 mL溶液,与原溶液相比,还会发生变化的是_________。
A. 溶液中HCl的物质的量 B. 溶液中HCl的物质的量浓度
C. 溶液中Cl-的数目 D. HCl的质量
(4)在配制上述溶液的过程中,下列情况对HCl溶液物质的量浓度有何影响(填“偏高”、“偏低”、或“无影响”)
①转移溶液后,未洗涤烧杯和玻璃棒就直接定容___________。
②容量瓶用蒸馏洗涤后残留有少量的水:___________。
③定容时,水未加到刻度___________。
(5)如果定容时加水超过容量瓶的刻度线,需要采取措施是__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)KClO3 + 6HCl(浓) = KCl + 3Cl2 + 3H2O中氧化剂是__________,还原剂是__________,请用双线桥表示电子转移数目_________________。当有l mol Cl2生成时,氧化剂与还原剂的物质的量之比为____________。
(2)3NO2 + H2O = 2HNO3 + NO中当电子转移4mol时,参加还原反应的NO2有__________mol,氧化产物与还原产物物质的量之比为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室从含溴化氢的废液中提取溴单质,下列说法中能达到实验目的的是( )
A.用装置 氧化废液中的溴化氢
氧化废液中的溴化氢
B.用装置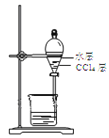 分离油层和水层
分离油层和水层
C.用装置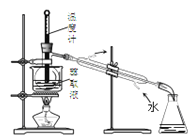 分离四氯化碳和液溴
分离四氯化碳和液溴
D.用仪器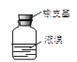 密封存放单质溴
密封存放单质溴
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.14gC2H4含有的单键数目为3NA
B.99℃时,1LpH=6的纯水中,含有的OH-数目为1×10-8NA
C.物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为NA
D.100 g CaS与CaSO4的混合物中含有32 g硫,则含有的氧原子数为1.75NA
查看答案和解析>>
科目: 来源: 题型:
【题目】铬元素及其化合物在生产、生活中具有广泛的用途。以某铬矿石(主要成分是Cr2O3,含Fe2O3、SiO2等杂质)为原料生产Cr2O3的流程如下:
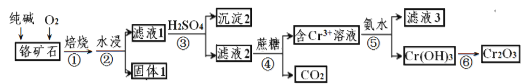
(1)Cr2O3在焙烧时生成Na2CrO4,写出第①步发生的所有方程式_________。
(2)沉淀2的化学式为_______。
(3)步骤③中CrO42-转化成Cr2O72- ,写出其离子方程式_______,硫酸能否换成盐酸并说明其理由______。
(4)滤液3中主要溶质的化学式为____________。
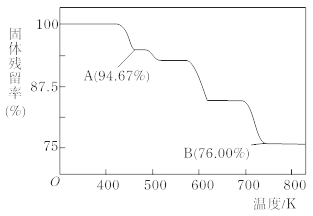
(5)CrO3的热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如下图所示,则B点时铬的氧化物化学式为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com