
科目: 来源: 题型:
【题目】下列所示物质的制备方法合理的是
A.实验室从海帶中提取单质碘取样→灼烧→溶解→过滤→萃取→蒸馏
B.金红石(主要成分TiO2)为原料生产金属Ti:金红石、焦炭![]() TiCl4
TiCl4![]() Ti
Ti
C.从卤水中(溶质主要是MgCl2)提取Mg:卤水![]() Mg(OH)2
Mg(OH)2![]() MgCl2(aq)
MgCl2(aq) ![]() MgCl2(s)
MgCl2(s) ![]() Mg
Mg
D.由食盐制取漂粉精NaCl(ag) ![]() Cl2
Cl2![]() 漂粉精
漂粉精
查看答案和解析>>
科目: 来源: 题型:
【题目】某溶液中可能含有下列6种离子中的某几种:Cl-、SO42-、CO32-、NH4+、Na+、K+。为确认溶液组成进行如下实验:(1) 200 mL上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30 g,向沉淀中加入过量的盐酸,有2.33 g沉淀不溶。(2) 向(1)的滤液中加入足量的NaOH溶液,加热,标准状况下产生能使湿润红色石蕊试纸变蓝的气体1.12 L。由此可以得出关于原溶液组成的正确结论是
A. 一定存在SO42-、CO32-、NH4+,可能存在Cl-、Na+、K+
B. 一定存在SO42-、CO32-、NH4+、Cl-,一定不存在Na+、K+
C. c(CO32-)=0.01mol·L-1,c(NH4+)>c(SO42-)
D. 如果上述6种离子都存在,则c(Cl-)>c(SO42-)
查看答案和解析>>
科目: 来源: 题型:
【题目】下面对SO2和CO2的描述正确的是
A. SO2为原子晶体,CO2为分子晶体
B. 中心原子采取的杂化方式:SO2为sp2杂化,CO2为sp杂化
C. 都是直线形结构
D. S原子和C原子上都没有孤电子对
查看答案和解析>>
科目: 来源: 题型:
【题目】叠氮化钠(NaN3)是一种易溶于水的白色晶体,微溶于乙醇,不溶于乙醚,可用于合成抗生素头孢菌素药物的中间体、汽车安全气囊的药剂等。氨基钠(NaNH2)的熔点为210℃,沸点为400℃,在水溶液中易水解。实验室制取叠氮化钠的实验步骤及实验装置如下:
①打开止水夹K1,关闭止水夹K2,加热装置D一段时间;
②加热装置A中的金属钠,使其熔化并充分反应后,再停止加热装置D并关闭K1;
③向装置A中b容器内加入加热介质并加热到210~220℃,打开止水夹K2,通入N2O;
④冷却,向产物中加入乙醇,减压浓缩结晶后,再过滤,并用乙醚洗涤,晾干。
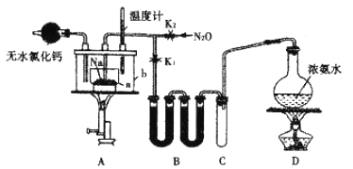
回答下列问题:
(1)装置B中盛放的药品为____________。
(2)氨气与熔化的钠反应生成NaNH2的化学方程式为__________。
(3)步骤③中,为了使反应受热均匀,A装置里a容器的加热方式为__________;生成NaN3的化学方程式为__________;N2O可由NH4NO3在240~245℃分解制得(硝酸铵的熔点为169.6℃),则应选择的气体发生装置是_____________(填序号)。

(4)步骤④中用乙醚洗涤的主要目的是______________。
(5)实验室用滴定法测定叠氮化钠样品中NaN3的质量分数:
①将2.500g试样配成500.00mL溶液。
②取50.00mL溶液置于锥形瓶中,加入50.00mL0.1010mol/L(NH4)2Ce(NO3)6溶液。
③充分反应后,将溶液稍稀释,向溶液中加入8mL浓硫酸,滴入3滴邻菲啰啉指示液,用0.0500mol/L(NH4)2Fe(SO4)2标准溶液滴定过量的Ce4+消耗溶液体积为29.00mL。测定过程的反应方程式为:2(NH4)2Ce(NO3)6+2NaN3=4NH4NO3+2Ce(NO3)3+2NaNO3+3N2↑;Ce4++Fe2+=Ce3++Fe3+,则试样中NaN3的质量分数为_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】高铁酸钾(K2FeO4)具有强氧化性,是一种新型多功能水处理剂,其生产工艺流程如下:
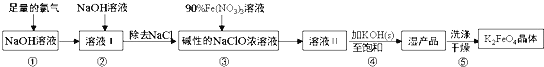
已知:K2FeO4在水溶液中易发生反应:4FeO42+10H2O4Fe(OH)3+8OH-+3O2↑,下列说法不正确的是( )
A.步骤③中氧化剂与还原剂的物质的量之比为3:2
B.步骤④中Na2FeO4转变为湿产品是因为K2FeO4溶解度更小
C.步骤⑤中的洗涤剂可用CH3COOK和异丙醇来配制
D.配制90%Fe(NO3)3溶液必需的玻璃仪器有容量瓶、烧杯、量筒、玻璃棒、胶头滴管等
查看答案和解析>>
科目: 来源: 题型:
【题目】“绿水青山就是金山银山”,因此研究NOx、SO2等大气污染物的妥善处理具有重要意义。
(1)SO2的排放主要来自于煤的燃烧,工业上常用氨水吸收法处理尾气中的SO2。
已知吸收过程中相关反应的热化学方程式如下:
①SO2(g)+NH3·H2O(aq)=NH4HSO3(aq) ΔH1=a kJ/mol;
②NH3·H2O(aq)+ NH4HSO3(aq)=(NH4)2SO3(aq)+H2O(l) ΔH 2=b kJ/mol;
③2(NH4)2SO3(aq)+O2(g)=2(NH4)2SO4(aq) ΔH 3=c kJ/mol。
则反应2SO2(g)+4NH3·H2O(aq)+O2(g)=2(NH4)2SO4(aq)+2H2O(l)的ΔH =______kJ/mol。
(2)燃煤发电厂常利用反应2CaCO3(s)+2SO2(g)+O2(g)![]() 2CaSO4(s)+2CO2(g) ΔH =-681.8 kJ/mol对煤进行脱硫处理来减少SO2的排放。对于该反应,在温度为T K时,借助传感器测得反应在不同时间点上各物质的浓度如下:
2CaSO4(s)+2CO2(g) ΔH =-681.8 kJ/mol对煤进行脱硫处理来减少SO2的排放。对于该反应,在温度为T K时,借助传感器测得反应在不同时间点上各物质的浓度如下:
时间/min 浓度/mol/L | 0 | 10 | 20 | 30 | 40 | 50 |
O2 | 1.00 | 0.79 | 0.60 | 0.60 | 0.64 | 0.64 |
CO2 | 0 | 0.42 | 0.80 | 0.80 | 0.88 | 0.88 |
①0~10 min内,平均反应速率v(SO2)=___________mol/(L·min)。
②30 min后,只改变某一条件,反应重新达到平衡。根据上表中的数据判断,改变的条件可能是___________(填字母)。
A.加入一定量的粉状碳酸钙 B.通入一定量的O2
C.适当缩小容器的体积 D.加入合适的催化剂
(3)NOx的排放主要来自于汽车尾气,可采用NSR(NOx储存还原)进行处理,NOx的储存和还原在不同时段交替进行,如图a所示。

①通过BaO和Ba(NO3)2的相互转化实现NOx的储存和还原。储存NOx的物质是_________。
②NOx储存转化为Ba(NO3)2过程中,参加反应的NO和O2的物质的量之比为_________。
(4)有人利用反应C(s)+2NO(g)![]() N2(g)+CO2(g) ΔH=34.0 kJ/mol,用活性炭对NO进行吸附。在密闭容器中加入足量的C和一定量的NO气体,保持恒压在不同温度下发生该反应,并分别在t秒时测得NO的转化率,如图所示:
N2(g)+CO2(g) ΔH=34.0 kJ/mol,用活性炭对NO进行吸附。在密闭容器中加入足量的C和一定量的NO气体,保持恒压在不同温度下发生该反应,并分别在t秒时测得NO的转化率,如图所示:

①由图可知,1050 K前反应中NO的转化率随温度升高而增大,其原因为 _______________;在1100 K时,CO2的体积分数为___________。
②用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp),在1050K1.1×106 Pa时,该反应的化学平衡常数Kp=______________________。
[已知:气体分压(P分)=气体总压(P)×体积分数]
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:2FeSO4·7H2O ![]() Fe2O3+SO2↑+SO3↑+14H2O↑。用下图所示装置检验FeSO4·7H2O的所有分解产物,下列说法不正确的是
Fe2O3+SO2↑+SO3↑+14H2O↑。用下图所示装置检验FeSO4·7H2O的所有分解产物,下列说法不正确的是
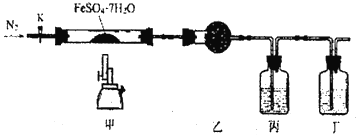
A. 乙、丙、丁中可依改盛装无水CuSO4、Ba(NO3)2溶液、品红溶液
B. 实验时应先打开K,缓缓通入N2,再点燃酒精喷灯
C. 甲中残留固体加稀硫酸溶解,再滴加KSCN,溶液变红
D. 还应在丁装置后面连接盛有NaOH溶液的洗气瓶
查看答案和解析>>
科目: 来源: 题型:
【题目】铝土矿的主要成分为Al2O3和SiO2(含有少量不溶性杂质),利用铝土矿制备Al(OH)3流程如下(所用化学试剂均过量)。
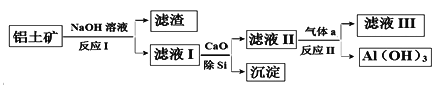
下列说法不正确的是
A. Al(OH)3可用作治疗胃酸过多
B. 加CaO除Si得到的沉淀主要成分为H2SiO3
C. 气体a成分为CO2
D. 滤液III中溶质为Ca(HCO3)2和NaHCO3
查看答案和解析>>
科目: 来源: 题型:
【题目】根据物质结构的有关性质和特点,回答下列问题:
(1)基态氮原子的外围电子排布图为_____________,基态镁原子核外电子有__________种空间运动状态。
(2)丙烯腈(CH2=CH-CN)分子中碳原子轨道杂化类型是____________,H、C、N元素的电负性由大到小的顺序为___________。
(3)配合物[Cu(CH3CN)4]BF4[四氟硼酸四(乙腈)合铜(I)]是有机合成中常见催化剂。该配合物中阴离子的空间构型为___________,与其互为等电子体的分子或离子是____________(各举1例)。
(4)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如下图所示,其晶胞边长为540.0pm,密度为__________g/cm3(列出计算式即可),a位置S2-离子与b位置Zn2+离子之间的距离为__________pm。
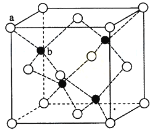
查看答案和解析>>
科目: 来源: 题型:
【题目】甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合制备甲醇,该反应的热化学方程式为CO(g)+2H2(g)=CH3OH(g) ΔH=-116kJ·mol-1。某些化学键的键能数据如表:
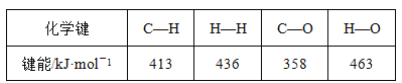
则CO中碳氧键的键能是
A.431kJ·mol-1B.946kJ·mol-1
C.1072kJ·mol-1D.1130kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com