
科目: 来源: 题型:
【题目】下列各组中的X和Y两种微粒,化学性质一定相似的是
A. 结构示意图:X为![]() ,Y为
,Y为 ![]()
B. X原子的核外电子排布式为1s2,Y原子的核外电子排布式为1s22s2
C. X原子的2p能级上有3个电子,Y原子的3p能级上有3个电子
D. X原子核外M层上仅有2个电子,Y原子核外N层上仅有2个电子
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式正确的是
A.向Na2SiO3中通入过量CO2:Na2SiO3 +2CO2+2H2O![]() H2SiO3↓+2HCO3-+2Na+
H2SiO3↓+2HCO3-+2Na+
B.KClO碱性溶液与Fe(OH)3反应:3ClO+2Fe(OH)3![]() 2FeO42+3Cl+4H++H2O
2FeO42+3Cl+4H++H2O
C.用热的NaOH溶液溶解S:3S+4OH- ![]() 2S2-+SO2↑+2H2O
2S2-+SO2↑+2H2O
D.酸性介质中KMnO4氧化H2O2:2MnO4-+5H2O2+6H+ ![]() 2Mn2++5O2↑+8H2O
2Mn2++5O2↑+8H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】某工业废水中仅含表中的离子中的5种(不考虑水的电离及离子的水解),且各种离子的物质的量浓度相等,均为0.1mol/L。
阳离子 | K+ Cu2+ Fe3+ Al3+ Fe2+ |
阴离子 | Cl- CO32- NO3- SO42- SiO32- |
甲同学欲探究废水的组成,进行了如下实验:
I.用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察)。
Ⅱ.取少量溶液,加入KSCN溶液无明显变化。
Ⅲ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变。
Ⅳ.向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断:
(1)Ⅲ中加入少量盐酸生成无色气体的离子方程式是____________________。
(2)将Ⅲ中红棕色气体(标况下)收集一满试管然后倒扣入水中(假设溶质不扩散),所得溶液的物质的量浓度为___________mol/L(精确到千分位)。
(3)甲同学最终确定原溶液中所含离子是__________________。
(4)另取100mL原溶液,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体质量为_____________g。
查看答案和解析>>
科目: 来源: 题型:
【题目】海水是宝贵的自然资源,从海水中可以提取多种化工原料,如图是某工厂对海水综合利用的示意图:
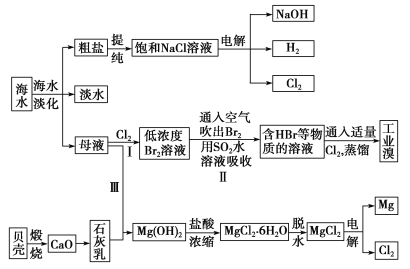
(1)在粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时所用的试剂有①盐酸;②氯化钡溶液;③氢氧化钠溶液;④碳酸钠溶液。则加入试剂的先后顺序是________(填编号)。
(2)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的是_____________。步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式:_______________________。
(3)从步骤Ⅲ得到的Mg(OH)2沉淀中混有少量的Ca(OH)2,除去少量Ca(OH)2的方法是向沉淀中加入MgCl2溶液,充分搅拌后经________(填操作方法)可得纯净的Mg(OH)2。
(4)电解无水氯化镁所得的镁蒸气在特定的环境里冷却后即为固体镁,下列物质中可以用作镁蒸气冷却剂的是________(填字母)。
A.H2 B.CO2 C.N2 D.O2 E.水蒸气
查看答案和解析>>
科目: 来源: 题型:
【题目】叠氮化钠(NaN3)常用作汽车安全气囊中的药剂。实验室制取叠氮化钠的原理、实验装置及实验步骤如下:
①打开装置D导管上的旋塞,加热制取氨气。
②再加热装置A中的金属钠,使其熔化并充分反应后,再停止加热装置D并关闭旋塞。
③向装置A中b容器内充入加热介质并加热到210~220℃,然后通入N2O。
④冷却,向产物中加入乙醇(降低NaN3的溶解度),减压浓缩结晶后,再过滤,并用乙醚洗涤,晾干。
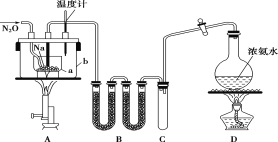
已知:I.NaN3是易溶于水的白色晶体,微溶于乙醇,不溶于乙醚;
II.NaNH2熔点210℃,沸点400℃,在水溶液中易水解。
请回答下列问题:
(1)装置B中盛放的药品为______。
(2)步骤①中先加热通氨气的目的是_______________;步骤②氨气与熔化的钠反应生成NaNH2的化学方程式为__________;步骤③中最适宜的加热方式为 ______(填“水浴加热”,“油浴加热”)。
(3)生成NaN3的化学方程式为 _______。
(4)图中仪器a用的是铁质而不用玻璃,其主要原因是_____。
(5)步骤④中用乙醚洗涤的主要目的是_______。
(6)实验室用滴定法测定叠氮化钠样品中NaN3的质量分数:①将2.500 g试样配成500.00 mL溶液。②取50.00 mL溶液置于锥形瓶中,加入50.00 mL 0.1010 mol·L-1(NH4)2Ce(NO3)6溶液。③充分反应后,将溶液稍稀释,向溶液中加入8 mL浓硫酸,滴入3滴邻菲啰啉指示液,用0.0500mol·L-1(NH4)2Fe(SO4)2标准溶液滴定过量的Ce4+,消耗溶液体积为29.00mL。测定过程的反应方程式为:2(NH4)2Ce(NO3)6+2NaN3=4NH4NO3+2Ce(NO3)3+2NaNO3+3N2↑;Ce4++Fe2+=Ce3++Fe3+;试样中NaN3的质量分数为_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】5.6 g铁粉投入到足量的100 mL 2 mol·L1的稀硫酸中,2 min时铁粉刚好溶解,下列表示这个反应的速率正确的是
A.v(Fe)=0.5 mol·L1·min1B.v(H2SO4)=1 mol·L1·min1
C.v(H2SO4)=0.5 mol·L1·min1D.v(FeSO4)=1 mol·L1·min1
查看答案和解析>>
科目: 来源: 题型:
【题目】氮化硼(BN)晶体有多种相结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂,但不能导电。立方相氮化硼是超硬材料,有优异的耐磨性。它们的晶体结构如图所示。关于这两种晶体的说法,正确的是
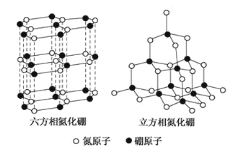
A. 立方相氮化硼含配位键B→N
B. 六方相氮化硼层间作用力小,所以质地软,熔点低
C. 两种氮化硼中的硼原子都是采用sp2杂化
D. 六方相氮化硼晶体其结构与石墨相似却不导电,原因是没有可以自由移动的电子
查看答案和解析>>
科目: 来源: 题型:
【题目】ClO2是一种黄绿色或橙黄色的气体,极易溶于水,可用于水的消毒杀菌、水体中Mn2+等重金属清除及烟气的脱硫脱硝。回答下列问题:
(1)将过硫酸钠(Na2S2O8)溶液加入亚氯酸钠(NaClO2)中可制备ClO2,该反应中氧化剂和还原剂的物质的量之比为_____。
(2)将ClO2通入MnSO4溶液,溶液中可检测到Cl-同时有黑色沉淀生成。该反应的离子方程式为__________。
(3)为研究ClO2脱硝的适宜条件,在1L200 mgL-1 ClO2溶液中加NaOH溶液调节pH,通入NO气体并测定NO的去除率,脱硝后N元素以NO3-形式存在,其关系如下图所示:
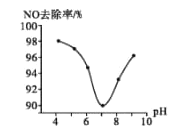
①实验中使用的ClO2溶液的物质的量浓度为______(保留三位有效数字);要使NO的去除率更高,应控制的条件是_________。
②当溶液pH>7时,NO的去除率增大的原因是ClO2与NaOH溶液反应可生成更强的吸收剂NaClO2,写出碱性条件下NaClO2脱除NO反应的离子方程式:_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】将13.6gCu和Cu2O组成的混合物加入250 mL一定浓度的稀硝酸中,固体完全溶解生成Cu(NO3)2和NO。向所得溶液中加入1.0 L 0.5 molL-1的NaOH溶液,生成沉淀的质量为19.6 g,此时溶液呈中性,且金属离子(钠离子除外)沉淀完全。下列说法正确的是( )
A.原固体混合物中,Cu和Cu2O的物质的量之比为1:1
B.原稀硝酸的浓度为2.4 mol·L-1
C.固体溶解后剩余硝酸的物质的量为0.05 mol
D.产生的NO的体积为2.24L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com