
科目: 来源: 题型:
【题目】网络趣味图片“一脸辛酸”,是在人脸上重复画满了辛酸的键线式结构(如图)。在辛酸的同分异构体中, 含有一个“-COOH”和三个“-CH3”的结构(不考虑立体异构),除![]() 外,还有( )
外,还有( )
A. 7种 B. 11种 C. 14种 D. 17种
查看答案和解析>>
科目: 来源: 题型:
【题目】【加试题】苯甲醛(微溶于水、易溶于有机溶剂,密度约等于水的密度)在碱性条件下发生歧化反应可以制备苯甲醛(在水中溶解度不大,易溶于有机溶剂,密度约等于水的密度)、苯甲酸。反应原理如下:
2C6H5CHO+NaOH![]() C6H5CH2OH+C6H5COONa
C6H5CH2OH+C6H5COONa
C6H5COONa+HCl![]() C6H5COOH+NaCl
C6H5COOH+NaCl
相关物质物理性质如下表:
苯甲醛 | 苯甲醇 | 苯甲酸 | 苯 | |
沸点/℃ | 178 | 205 | 249 | 80 |
熔点/℃ | 26 | -15 | 122 | 5.5 |
苯甲酸在水中的溶解度 | ||
17℃ | 25℃ | 100℃ |
0.21g | 0.34g | 5.9g |
实验流程如下:

(1)第Ⅰ步需连续加热1小时(如图1),其中加热混合固定装置为画出。
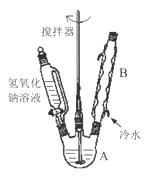
仪器A的名称为_______,若将仪器B改为仪器C,效果不如B,说明原因:_______。
(2)操作②有关分液漏斗的使用不正确的是_______
A.分液漏斗在使用之前必须检验是否漏水
B.分液漏斗内的液体不能过多,否则不利于振荡
C.充分振荡后将分液漏斗置于铁架台上静置,分层后立即打开旋塞进行分液
D.分液时待下层液体放完后立即关闭旋塞,换掉烧杯再打开旋塞使上层液体流下
(3)操作③是用沸水浴加热蒸馏,再进行操作④(如图2),收集______℃的馏分。图2中有一处明显错误,正确的应改为_____________。
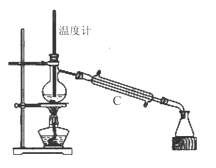
(4)抽滤时(如图3)烧杯中苯甲酸晶体转入布氏漏斗时,杯壁上还粘有少量晶体,用_____冲洗杯壁上残留的晶体。抽滤完成后用少量冰水对晶体进行洗涤,洗涤应____________。
(5)用电子天平准确称取0.2440g苯甲酸于锥形瓶中加100mL蒸馏水溶解(必要时可以加热),再用0.1000mol/L的标准氢氧化钠溶液滴定,共消耗标准氢氧化钠溶液19.20mL,苯甲酸的纯度为_____%。
查看答案和解析>>
科目: 来源: 题型:
【题目】除去空气中的二氧化硫和氨氧化物气体对环境保护有重要意义。
(1)二氧化硫易溶于水,溶于水后所得溶液中H2SO3、HSO3-和SO32- 占三种粒子总数的比例随pH的变化如下图所示。由图可知H2SO3 的电离平衡常数Ka1=____________。

(2)利用尿素[CO(NH2)2]水解的溶液可以吸收含SO2 的空气。已知尿素水解放热,常温下水解反应较慢,水解的反应方程式如下:CO(NH2)2+H2O=H2NCOONH4(氨基甲酸铵)。
①氨基甲酸铵会与空气中的SO2 和O2 反应生成(NH4)2SO4,该反应的化学方程式为__________。
②一定条件下,用尿素溶液吸收含SO2 的空气,测得SO2 的吸收率随溶液的温度变化如图甲所示。温度高于60 ℃时,SO2 的吸收率逐渐升高的原因是_____________。
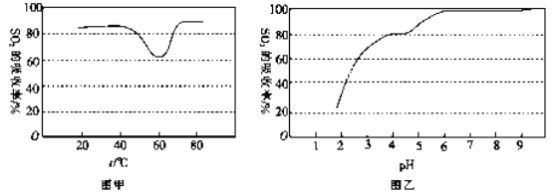
③尿素溶液吸收SO2 的吸收率随溶液的pH变化如图乙所示。尿素溶液吸收含SO2的空气后溶液的pH会降低,为提高SO2 的吸收率和充分回收产物,最好向溶液中加入_____(填溶液的名称)并控制pH 为_______。
(3)一种电化学脱硝法的原理如图所示。
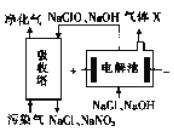
①电解池阴极所发生的电极反应为_____________。
②相同条件下通入的污染气和生成的X 的体积比为40 :3,污染气中NO 和NO2 占总体积的10%,若NaClO完全反应,污染气中NO和NO2 被完全吸收且其余气体不参与反应,则NO和NO2 的体积比为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.已知反应:R-CH=CH-O-R′(烃基烯基醚) ![]() R-CH2CHO + R′OH
R-CH2CHO + R′OH
烃基烯基醚A的相对分子质量Mr(A)=162,水解产物B的相对分子质量Mr(B)=46。与A相关的化学反应如下,请回答下列问题:
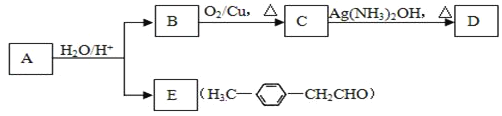
(1)A的结构简式为______________________,该分子中有_________种环境的氢原子。
(2)B的名称是__________,写出B→C反应的化学方程式:________________________。
(3)写出C → D反应的化学方程式:_______________________________________。
(4)写出同时符合下列条件的E的所有同分异构体的结构简式:①属于芳香醛 ②苯环上有两种不同环境的氢原子_________________________。
II.已知: ![]() +ClCH2CH3
+ClCH2CH3 +HCl
+HCl
(5)请写出以![]() 、B和苯作为原料,合成
、B和苯作为原料,合成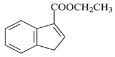 的流程图(注:无机试剂任用)____________________。
的流程图(注:无机试剂任用)____________________。![]()
![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】“清肺排毒汤”来源于中医经典方剂组合,对新冠肺炎病毒感染的轻型、普通型的治疗具有良好的效果。其中的一味中药黄芩的有效成分的结构简式如图所示,下列说法错误的是( )
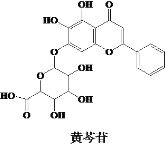
A.黄芩苷是芳香化合物,其分子式为C21H18O11
B.黄芩苷可发生取代、加成、氧化反应
C.黄芩苷分子中苯环上的一氯代物有3种
D.1 mol黄芩苷与足量钠反应,所得H2的体积在标准状况下为67.2 L
查看答案和解析>>
科目: 来源: 题型:
【题目】硼位于第ⅢA族,三氯化硼是无色、强烈臭味的发烟液体或气体,属于化学危险品,主要用于半导体硅的掺杂源、有机合成的催化剂,还应用于高纯硼、有机硼(如:乙硼烷B2H6)的制取。某同学设计利用Cl2和单质B制备三氯化硼(BCl3)的装置示意图。查阅资料:①BCl3沸点12.5℃,熔点-107.3℃,易潮解;②2B+6HCl![]() 2BCl3↑+3H2↑;③硼与硅“对角线”相似,都能与氢氧化钠溶液反应。请回答下列问题:
2BCl3↑+3H2↑;③硼与硅“对角线”相似,都能与氢氧化钠溶液反应。请回答下列问题:
(1)装置A中二氧化锰能与浓盐酸在加热条件下发生反应制取氯气,该反应的离子方程式:______________________________,洗气瓶G中用Na2SO3溶液除去Cl2反应的化学方程式是____________________________。
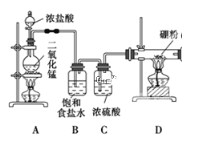
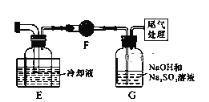
(2)E装置的作用是_________________________,如果拆去B装置,可能导致的后果是:_____________________________________________________________。
(3)写出D装置中发生反应的化学方程式:______________________________,实验中可用一个盛装__________(填:试剂名称)的干燥管代替F+G装置,使实验更简便。
(4)BCl3遇水剧烈反应生成硼酸(H3BO3)和白雾,写出该反应方程式:____________。
(5)为了顺利完成实验,正确的操作是____________(填:数字编号)。
①先点燃A处酒精灯,后点燃D处酒精灯 ②先点燃D处酒精灯,后点燃A处酒精灯③同时点燃A、D处酒精灯
(6)硼纤维是在金属丝上沉积无定形的硼而形成的无机纤维,通常在炽热的钨丝表面发生如下的反应:3H2+2BCl3 =2B+6HCl↑。要想验证制得的产品中是否含硼粉:应取少量样品于试管中,滴加浓____________(填:化学式)溶液,观察是否有气泡产生。
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E、F、X为周期表前四周期的元素,A→F原子序数依次增大。A位于第一周期,B原子有3个不同的能级,各能级的电子数相等;D的基态原子2p能级上未成对电子数与B原子的相同;D2-离子与E2+离子具有相同的电子层结构;F元素有“生物金属”之称,F4+离子和氩原子核外电子排布相同;X是第三周期电负性最大的元素。回答下列问题:
(1)F基态原子的核外电子排布式______________ ,用过量的E粉与 FX4高温条件下反应生成金属F,该化学方程式为___________________。
(2)在A与上述元素形成的分子中,中心原子采取sp3杂化的是________________(写出两种)。
(3)下图是BD2分子的晶胞模型,图中显示出的BD2分子数为14个。实际上一个BD2晶胞中含有__________个BD2分子。
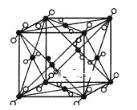
![]() 代表一个BD2分子
代表一个BD2分子
(4)B元素可形成B60单质,从晶体类型来看B60属于__________晶体。科学家把B60与金属钾掺杂在一起制造了一种富勒烯化合物,其晶胞如图(白球(C60)位于立方体的体心和顶点,小黑球(K)则位于立方体的面上),该化合物中B60与钾原子个数比为________________。
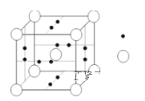
(5)已知单晶锗、晶体硅与金刚石的晶体类型完全相同,下图所示是金刚石的晶胞结构,请回答:
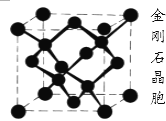
在单晶锗的一个晶胞内含有__________个锗原子。
(6)若向CuSO4溶液中加入少量氨水生成蓝色絮状沉淀,继续加入过量氨水沉淀溶解,得到深蓝色的透明溶液,最后向该溶液中加入一定量的乙醇,所析出晶体的化学式为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】运用化学反应原理研究氮、硫单质及其化合物性质是一个重要的课题。回答下列问题:
(1)恒容密闭容器中,工业固氮:N2(g)+3H2(g) ![]() 2NH3(g)的平衡常数K值和温度关系如表:
2NH3(g)的平衡常数K值和温度关系如表:
温度/℃ | 25 | 200 | 300 | 400 | 450 |
K | 5108 | 1.0 | 0.86 | 0.507 | 0.152 |
①从上表列出数据分析,该反应为__________反应(填:“吸热”或“放热”)。
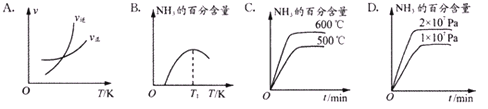
②有关工业合成氨的研究成果,曾于1918年、1931年、2007年三次荣膺诺贝尔奖。下列关于关于合成氨反应描述的图像中,不正确的是_________(填:字母选项)。
③450℃时,测得某时刻氨气、氮气、氢气物质的量浓度分别为3mol/L、2mol/L、1mol/L时,该反应的v(正)____________v(逆)(填“>”、“=”或“<”)。
(2)近年,科学家又提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:2N2(g)+6H2O(1)![]() 4NH3(g)+3O2(g),则其反应热ΔH=___________________。(已知:N2(g)+3H2(g)
4NH3(g)+3O2(g),则其反应热ΔH=___________________。(已知:N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4kJ·mol-1 2H2(g) +O2(g)
2NH3(g) △H=-92.4kJ·mol-1 2H2(g) +O2(g)![]() 2H2O(l) △H=-571.6kJ·mol-1 )
2H2O(l) △H=-571.6kJ·mol-1 )
(3)联氨(N2H4)、二氧化氮(NO2)可与KOH溶液构成碱性燃料电池,其电池反应原理为2N2H4 +2NO2 = 3N2+8H2O。则负极的电极反应式为__________________________。
(4)部分金属硫化物的溶度积常数(Ksp)如下表:
硫化物 | CuS | ZnS | MnS | FeS |
Ksp | 6.3×10-36 | 2.9×10-25 | 2.5×10-13 | 6.3×10-18 |
由列表数据分析推知,向含有Cu2+、Zn2+、Mn2+、Fe2+的工业废水中加入MnS粉末的作用是_____________________________________。
(5)工业上从废铅蓄电池废液回收铅的过程中,常用纯碱溶液与处理后的铅膏(主要含PbSO4)发生反应:PbSO4(s)+CO32-(aq)![]() PbCO3(s)+SO42-(aq)。已知溶度积常数:Ksp(PbSO4)=1.6×10-8,Ksp(PbCO3)=7.4×10-14,则该反应的化学平衡常数K =_______。
PbCO3(s)+SO42-(aq)。已知溶度积常数:Ksp(PbSO4)=1.6×10-8,Ksp(PbCO3)=7.4×10-14,则该反应的化学平衡常数K =_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知二氧化硅、二氧化硫和二氧化碳都是酸性氧化物,化学性质具有一定的相似性,镁和钠的化学性质也具有一定的相似性。

用如上图所示装置进行镁和二氧化硫的实验,其中A是制备二氧化硫的发生装置。
(1)选择制取二氧化硫的合适试剂________(填序号)。
①10%的硫酸溶液 ②80%硫酸溶液 ③亚硫酸钠固体 ④亚硫酸钙固体
(2)写出装置B中发生反应的化学方程式: ______________________。
(3)你认为该装置的不足之处是_______________________________(任写2条)。
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E是原子序数依次增大的5种短周期元素。A与D、C与E分别同主族,E原子的最外层电子数比次外层少2个。A、B两元素可形成BA3气体分子甲,甲能使湿润的红色石蕊试纸变蓝且每个分子内含10个电子。请回答下列问题:
(1)气体甲溶于水所得溶液呈碱性的原因(用电离方程式表示)______________。
已知:甲、乙、丙、丁4种物质之间的转化关系如下图(注:反应条件或产物已略去)。
甲![]() 乙
乙![]() 丙
丙![]() 丁
丁
请写出从甲→乙转化的化学方程式____________________________________________。
(2)用电子式表示离子化合物D2C2的形成过程____________________________________。
(3)DAEC3和DAEC4的溶液均呈现_______(填:“酸”“碱”“中”)性,在DAEB3溶液中离子浓度由大到小的顺序是________________________________;如果将两种溶液混合后发生反应的离子方程式为____________________________________。
(4)已知A2EC3和A2EC4两种酸中酸性更强的是后者,请从分子结构和性质的关系角度解释这种差异产生的原因___________________________________。
(5)B元素的三氯化物(BCl3)常温下是一种淡黄色液体,具有三角锥型的分子结构。下列关于BCl3分子的描述中不正确的是_________________。
A.BCl3分子中B显-3价、采用SP3杂化
B.BCl3分子间可形成氢键,比PCl3难挥发
C.B、C元素的电负性B< C ,第一电离能B>C
D.BCl3遇水发生水解反应产物是BH3和HClO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com