
科目: 来源: 题型:
【题目】如图所示阴阳膜组合电解装置用于循环脱硫,用NaOH溶液在反应池中吸收尾气中的二氧化硫,将得到的Na2SO3溶液进行电解又制得NaOH。其中a、b离子交换膜将电解槽分为三个区域,电极材料为石墨,产品C为H2SO4溶液。下列说法正确的是( )

A. b为只允许阳离子通过的离子交换膜
B. 阴极区中B最初充入稀NaOH溶液,产品E为氧气
C. 反应池采用气、液逆流方式,目的是使反应更充分
D. 阳极的电极反应式为SO32-+2e-+H2O===2H++SO42-
查看答案和解析>>
科目: 来源: 题型:
【题目】某课外兴趣小组通过如图所示的流程来制取少量亚硝酸钠晶体(NaNO2),并对其进行纯度测定和相关性质的实验。
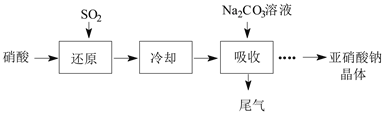
已知:Ⅰ.Na2CO3+NO+NO2=2NaNO2+CO2;Na2CO3+2NO2=NaNO2+NaNO3+CO2
Ⅱ.NaNO2是白色固体,易被氧化。
(1)“还原”步骤中被还原的元素是___(填元素符号)。此时SO2从底部通入,硝酸从顶部以雾状喷下,其目的是___。
(2)若使“吸收”步骤中NOX完全转化为NaNO2,则理论上“还原”步骤中SO2与HNO3的物质的量之比为___。
(3)该课外兴趣小组对实验制取的NaNO2晶体进行纯度测定:
a.称取2.000g样品,将其配成250mL溶液。
b.先向锥形瓶内加入40.00mL0.100mol·L-1的H2SO4溶液,加热至40~50℃。冷却后再向其中加入20.00mL0.100mol·L-1KMnO4溶液,充分混合。
c.最后用待测的样品溶液与之恰好完全反应,重复三次,平均消耗样品溶液50.00mL。(NaNO2与KMnO4反应的关系式为:2KMnO4~5NaNO2)
①整个测定过程中应迅速操作,不宜耗时过长,否则样品的纯度___(“偏大”、“偏小”或“无影响”),原因是___。
②通过计算,该样品中NaNO2的质量分数是___,可能含有的杂质有___(写出其中一种即可)。
(4)该课外兴趣小组将NaNO2溶液逐滴加入到含淀粉KI的酸性溶液中,溶液变蓝,同时放出NO气体,该反应的离子方程式是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。

(1)请写出元素d的基态原子电子排布式______________________________________________________。
(2)b元素的氧化物中b与氧元素之间的共价键类型是_________________。(填“极性键”、“非极性键”)其中b原子的杂化方式是________。
(3)a单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。

若已知a的原子半径为d,NA代表阿伏加德罗常数,a的相对原子质量为Mr,则一个晶胞中a原子的数目为________,该晶体的密度为 _______________________________(用字母表示)。
查看答案和解析>>
科目: 来源: 题型:
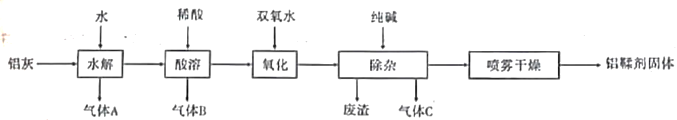
【题目】铝鞣剂主要成分为Al(OH)2Cl,主要用于揉制皮革。利用铝灰(主要成分为Al、Al2O3、AlN,FeO等)制备铝鞣剂的一种工艺如图所示:
请回答下列问题:
(1)气体A、气体C的分子式为_________、______________
(2)产生气体B的化学方程式为:________________________________________________
(3)氧化时,发生反应的离子方程式为:__________________________________________
(4)废渣的主要成分为__________________(填化学式)。
(5)某同学设计如下方案测定铝鞣剂样品中Al(OH)2Cl质量分数。
操作Ⅰ:准确称取所制备的铝鞣剂m g放入烧杯中。
操作Ⅱ:加入_____________(填试剂名称),并用玻璃棒搅拌至固体全部溶解。
操作Ⅲ:加入足量___________(填化学式)溶液,充分反应,过滤、_________、__________得固体n g。根据所测数据即可计算出样品中Al(OH)2Cl质量分数。
查看答案和解析>>
科目: 来源: 题型:
【题目】某工厂的固体废渣中主要含Cu和CuO,还含有少量Cu2O和SiO2等。利用该固体废渣制取Cu(NO3)2的部分工艺流程如图所示:
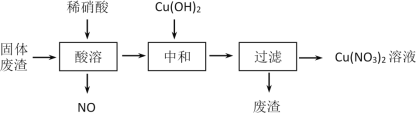
(1)Cu与稀硝酸反应的离子方程式为___。
(2)酸溶时,反应温度不宜超过70℃,其主要原因是___,若保持反应温度为70℃,欲加快反应速率可采取的措施为___(写出一种即可)。
(3)过滤后所得废渣的主要成分的化学式为___。
(4)Cu(NO3)2晶体受热易分解成CuO,同时产生NO2和O2,该反应的化学方程式为___,由Cu(NO3)2溶液制备Cu(NO3)2晶体的操作方法是:蒸发浓缩、冷却结晶、过滤、___、___。
查看答案和解析>>
科目: 来源: 题型:
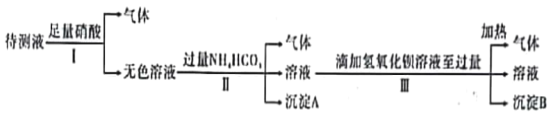
【题目】已知某无色溶液X可能由K+、Mg2+、Cu2+、Ag+、Ba2+、Al3+、Fe2+、AlO2-、CO32-、SO42-、I-、SiO32-,MnO4-中的N种离子组成。某化学兴趣小组通过下列实验确定了其组成:
回答下列问题:
(1)不用做实验就可以肯定原溶液X中不存在的离子是_______________(填离子符号)。
(2)通过上述实验知,X溶液中一定存在__________种离子(填数字;不考虑H+、OH-)。
(3)在上述滴加氢氧化钡溶液过程中,开始阶段发生反应的离子方程式一定有_____________
(4)该化学兴趣小组的同学为了进一步确定白色沉淀B的成分,取一定量经洗涤后的B与Y溶液反应,沉淀B的物质的量与Y溶液体积之间的关系如图所示。Y可能为____________。B的组成为__________________
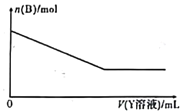
查看答案和解析>>
科目: 来源: 题型:
【题目】某烃类化合物A的质普图表明其相对分子质量为84,红外光谱表明分子中含有碳碳双键,核磁共振氢谱表明分子中只有一种类型的氢。在下图中,D1、D2互为同分异构体,E1、E2互为同分异构体
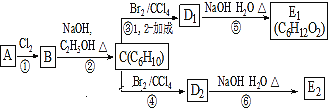
(1)A中的碳原子是否都处于同一平面?__________(填“是”或者“不是”)。
(2)反应②的化学方程式为__________。
(3)C的化学名称是__________,其反式加聚产物的结构简式是__________。
(4)E2在Cu催化作用下氧化的化学方程式为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】中国工程院院士李兰娟团队发现阿比朵尔在10~30微摩尔浓度下,能有效抑制冠状病毒达60倍,并有显著抑制病毒对细胞的病变效应。“阿比朵尔”是抗击新型冠状病毒潜在用药,其合成路线如下:
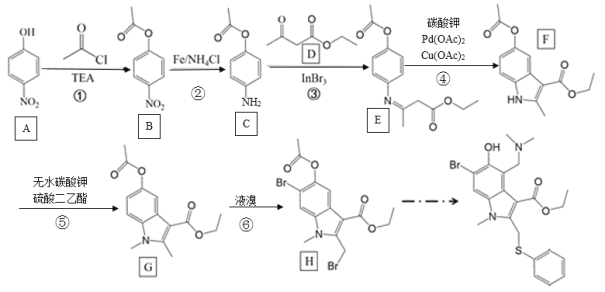
回答下列问题:
②(1)有机物A的名称是____________。
(2)反应②、⑥反应类型分别是_________、______________。
(3)F中含氧官能团的名称是_______________;G的分子式为_______________。
(4)请写出反应③的化学反应方程式____________________________________。
(5)M是B的一种同分异构体,满足下列条件的同分异构体有________种;其中核磁共振氢谱为有4组峰,峰面积之比为2:2:2:1的结构简式为_________。
①苯环上有3个取代基;②能发生银镜反应;③能发生水解反应,且1 mol M水解消耗4mol NaOH 。
(6)设计由甲苯和2-丙醇为原料制备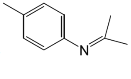 的合成路线________。
的合成路线________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某有机物结构简式如下图所示,下列说法正确的是
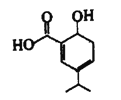
A. 分子式为C10H12O3 B. 能使酸性KMnO4溶液或溴水褪色
C. lmol该有机物可中和2molNaOH D. 1mol该有机物最多可与3molH2发生加成反应
查看答案和解析>>
科目: 来源: 题型:
【题目】请回答下列问题:
(1)近年来,人类生产、生活所产生的污染物,使雾霾天气逐渐增多。灰霾粒子比较小,平均直径大约在1000~2000nm左右。下列有关说法正确的是_____________
A.灰霾属于纯净物 B.雾霾天气,儿童、老年人应减少户外活动
C.灰霾能发生丁达尔现象 D.减少燃煤用量能降低灰霾天气的产生频率
(2)雾是由大量悬浮在近地面空气中的微小水滴或冰晶组成的气溶胶系统。雾丁达尔效应与水蒸汽有关,欲在树林中观察到丁达尔现象,你认为一天中最有可能观察到该现象的时间是____________,理由是___________________________________________________________
(3)为了消除SO2的污染,工业上采用石灰石-石膏湿法烟气脱硫工艺来降低含硫燃料燃烧排放的SO2。该技术的工作原理是使烟气中的SO2与浆液中的石灰石以及鼓入的空气反应生成生石膏(CaSO4·2H2O)。
①写出该工艺的化学方程式:______________________________________;该反应中每消耗标况下11.2L SO2,转移电子的物质的量为_____________
②若燃煤的含硫量(硫单质)为4%,燃烧1吨该燃煤生成的SO2有96%转化为生石膏,然后经过加热脱水形成熟石膏(2CaSO4·H2O),则可获得熟石膏_____________吨。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com