
科目: 来源: 题型:
【题目】常温下,NaOH溶液滴定亚硫酸氢钾(亚硫酸的Ka1=12×10-2,Ka2=63×10-8)溶液,滴定过程中溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。下列叙述错误的是
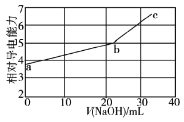
A.b点的混合溶液pH不可能等于7
B.离子浓度和种类会影响溶液的导电能力
C.C点的混合溶液中,c(OH-)>c(Na+)>c(K+)
D.Na+与SO32-的导电能力之和大于HSO3-的导电能力
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:
CO(g)+ 2H2(g)![]() CH3OH(g) △H
CH3OH(g) △H
(1)已知CO(g)、H2(g)的标准燃烧热分别为 △H=-283kJmol-1, △H=-286kJmol-1,且CH3OH(g)+3/2O2(g) ![]() CO2(g)+2H2O(l) △H=-761kJmol-1;则CO(g)+ 2H2(g)
CO2(g)+2H2O(l) △H=-761kJmol-1;则CO(g)+ 2H2(g)![]() CH3OH(g)的△H= ___________。
CH3OH(g)的△H= ___________。
(2)为了提高CO和H2制备甲醇生产效率和产量;工业生产中通常采取的措施是___________________________________________。(写出两点)
(3)实验室模拟用CO和H2反应来制甲醇,在250 ℃下,将一定量的CO和H2投入10 L的密闭容器中,各物质的物质的量浓度(mol·L-1)变化如下表所示:
2 min | 4 min | 6 min | |
CO | 0.07 | 0.05 | 0.05 |
H2 | x | 0.10 | 0.10 |
CH3OH | 0.03 | 0.05 | 0.05 |
①250 ℃时,该反应的平衡常数K=___________;
②在图1中画出反应开始至第6 min时H2的物质的量的变化曲线,并标出合适的纵坐标。_______
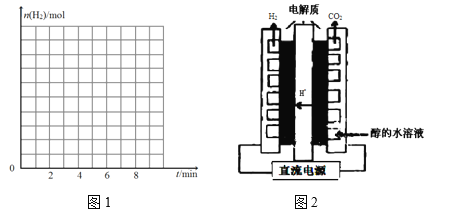
(4)利用电解甲醇水溶液制备氢气最大的优点就是需要的电压低,装置如图2,写出 阳极电极反应方程式____________________________________________________,电解的总反应化学方程式__________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】Phenolphthalein是常用酸碱指示剂,其结构如图所示。有关该有机物说法正确的是
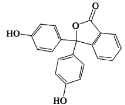
A.分子式为C20H12O4
B.含有的官能团有羟基、酯基、羧基
C.可以发生取代反应、加成反应和氧化反应
D.1mol该物质与H2和溴水反应,消耗H2和Br2的最大值分别为10mol和4mol
查看答案和解析>>
科目: 来源: 题型:
【题目】重铬酸钾是一种重要的化工原料,工业上由铬铁矿(主要成分为FeOCr2O3、SiO2等)制备,制备流程如图所示:

已知:a.步骤①的主要反应为:2FeOCr2O3+4Na2CO3+ 7NaNO3 ![]() 4Na2CrO4+Fe2O3+4CO2+7NaNO2
4Na2CrO4+Fe2O3+4CO2+7NaNO2
b.Cr2O42-+2H+ ![]() Cr2O72-+H2O,下列说法不正确的是
Cr2O72-+H2O,下列说法不正确的是
A. 步骤①反应中Na2CrO4和Fe2O3为氧化产物
B. 步骤①熔融、氧化可以在石英坩埚中进行
C. 滤渣2中含有H2SiO3
D. 步骤④调滤液2的pH使之变小有利于Cr2O72-生成
查看答案和解析>>
科目: 来源: 题型:
【题目】根据如图所示示意图,下列说法不正确的是
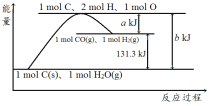
A. 反应的热化学方程式可表示为C(s)+H2O(g)![]() CO(g)+H2(g) ΔH=(b-a) kJ·mol-1
CO(g)+H2(g) ΔH=(b-a) kJ·mol-1
B. 该反应过程反应物断键吸收的能量一定大于生成物成键放出的能量
C. 使用催化剂无法改变该反应的ΔH
D. nmol C和n mol H2O反应生成nmol CO和nmol H2吸收的热量一定为131.3nkJ
查看答案和解析>>
科目: 来源: 题型:
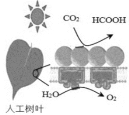
【题目】CO2的捕捉、封存与再利用是实现温室气体减排的重要途径之一。请回答:
(1)二氧化碳的电子式为__________。
(2)一种正在开发的利用二氧化碳制取甲酸(HCOOH)的途径如图所示,图中能量主要转化方式为_____________ ,CO2和H2O转化为甲酸的化学方程式为____________。
(3)目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g)。
①恒容容器中,能加快该反应速率的是_______。
a.升高温度 b.从体系中分离出CH3OH c.加入高效催化剂 d.降低压强
②在体积为2L的密闭容器中,充入1molCO2和3molH2,测得CO2的物质的量随时间变化如图所示。从反应开始到5min末,用H2浓度变化表示的平均反应速率________________。
t/min | 0 | 2 | 5 | 10 | 15 |
n(CO2)/mol | 1 | 0.75 | 0.5 | 0.25 | 0.25 |
③在相同温度、恒容的条件下,能说明该反应已达平衡状态的是_______(填序号)。
a.CO2、H2、CH3OH、H2O的浓度均不再改变化
b.n(CO2):n(H2):n(CH3OH):n(H2O)=1:1:1:1
c.容器中混合气体的密度不变
d.v消耗(H2)=3v消耗(CH3OH)
e.体系压强不变
(4)下列一些共价键的键能如下表所示:
化学键 | H-H | H-O | C=O | C-H | C-O |
键能kJ/mol | 436 | 463 | 803 | 414 | 326 |
反应CO2(g)+3H2(g)CH3OH(g)+H2O(g),______(填“吸收”或“放出”) 的热量为_____kJ
查看答案和解析>>
科目: 来源: 题型:
【题目】在不同温度下,水溶液中c(H+)与c(OH-)关系如图所示。下列说法不正确的是
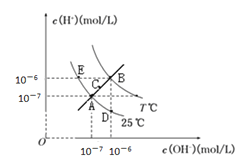
A. 图中五点Kw间的关系:B>C>A=D=E
B. 在温度不变的水中,加入适量的NH4Cl,无法实现从A点变到C点
C. D点对应的水溶液中,可能有NH4+、Fe3+、Cl-、NO3-大量同时存在
D. 若处在B点时,将pH =2的硫酸溶液与 pH = 10的KOH溶液等体积混合,所得溶液呈中性
查看答案和解析>>
科目: 来源: 题型:
【题目】某一环保电池可以消除污染,并产生参与大气循环的物质,装置如图所示。下列说法不正确的是
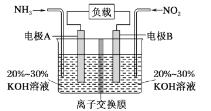
A.电极A极反应式为2NH3-6e-=N2+6H+
B.为使电池持续放电,离子交换膜需选用阴离子交换膜
C.当有4.48LNO2(标准状况)被处理时,转移电子为0.8mol
D.该电池既能实现有效消除氮氧化物的排放,又能充分利用化学能
查看答案和解析>>
科目: 来源: 题型:
【题目】二氧化钛在一定波长光的照射下,可有效降解甲醛、苯等有机物,效果持久,且自身对人体无害。某课题组研究了溶液的酸碱性对TiO2光催化染料R降解反应的影响,结果如图所示。下列判断不正确的是
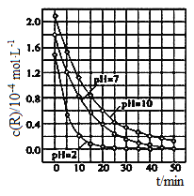
A. 在0~20min之间,pH=7时R的降解速率为7×10-6mol·L-1·min-1
B. R的起始浓度不同,无法判断溶液的酸碱性对R的降解速率的影响
C. 在这三种pH条件下,二氧化钛对pH=2的R溶液催化降解效率最好
D. 在0~50 min之间,R的降解百分率pH=2等于pH=7
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关实验现象或实验结论的说法不正确的是( )
A.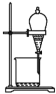 往KI溶液中加入新制氯水和CCl4,充分振荡、静置,液体分层,下层呈紫红色
往KI溶液中加入新制氯水和CCl4,充分振荡、静置,液体分层,下层呈紫红色
B.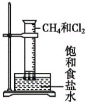 光照CH4和Cl2的混合气,量筒内液面上升,内壁附着油状液体,量筒内水溶液呈酸性
光照CH4和Cl2的混合气,量筒内液面上升,内壁附着油状液体,量筒内水溶液呈酸性
C. 往外拉动针筒活塞,观察水中玻璃导管口是否有气泡冒出,可检查装置气密性
往外拉动针筒活塞,观察水中玻璃导管口是否有气泡冒出,可检查装置气密性
D.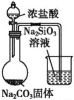 往烧瓶中滴入浓盐酸,根据实验现象,可判断盐酸、碳酸、硅酸的酸性强弱
往烧瓶中滴入浓盐酸,根据实验现象,可判断盐酸、碳酸、硅酸的酸性强弱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com