
科目: 来源: 题型:
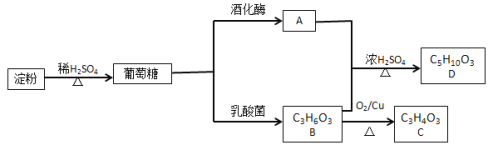
【题目】葡萄糖不仅是重要的营养物质,而且还能转化成其他重要的调味品。以淀粉为原料在一定条件下可获得有机物葡萄糖、A、B、C、D,其相互转化关系如图。已知C不能发生银镜反应,D为有浓郁香味,不溶于水的油状液体。
请回答:
(1)与A互为同分异构体的结构式________。
(2) B→C的反应类型是________。
(3) A+ B→D的化学方程式是________________________。
(4) 下列说法正确的是________。
A 有机物A与金属钠反应比水与金属钠反应要剧烈
B 有机物A、B、D可用饱和Na2CO3溶液鉴别
C 两分子B在浓硫酸作用下可以形成六元环状化合物
D 往淀粉水解液中,加入足量的NaOH溶液,再加入碘水,如果溶液未变蓝色,则说明淀粉水解完成
查看答案和解析>>
科目: 来源: 题型:
【题目】回答下列问题:
(1)将等质量的镁分别与足量的CO2、O2、N2、空气中充分燃烧,反应前后固体增重由大到小的顺序为___。
(2)在常温下,实验室用固体亚硫酸钠和中等浓度的硫酸制取SO2气体。将制得的SO2气体通入紫色石蕊试液,可观察到的现象为___。
(3)在常温下,把NO气体压缩到1.01×108Pa,在一个体积固定的容器里加热到50℃,发现气体的压力迅速下降,压力降至略小于原压力![]() 就不再改变,已知其中一种产物为N2O,写出上述变化的化学方程式___。
就不再改变,已知其中一种产物为N2O,写出上述变化的化学方程式___。
(4)按如图进行实验,试管中装有NO,然后缓慢地通入84mLO2,充分反应后液面高度不变,则原试管中装有NO的体积为___。
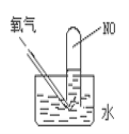
(5)标况下,将一定体积的盛满NO、NO2、O2的混合气体的试管倒立于水槽中,水充满整个试管,则试管内的溶液的物质的量浓度范围是(假定试管内溶液不扩散)为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室利用如图装置进行中和热的测定。回答下列问题:
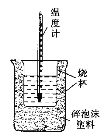
(1)该图中有两处未画出,它们是____________、____________。
(2)在操作正确的前提下提高中和热测定的准确性的关键是____________。
(3)如果用0.50 mol/L的盐酸和氢氧化钠固体进行实验,则实验中所测出的“中和热”将____________(填“偏大”、“偏小”或“不变”);原因是____________。
(4)乙醇是未来内燃机的首选环保型液体燃料。2.0g乙醇完全燃烧生成液态水放出59.43 kJ的热量,表示乙醇燃烧热的热化学方程式为____________________________。
(5)由N2O和NO反应生成N2和NO2的能量变化如图所示,若生成1molN2,其△H=__________kJ·mol-1。
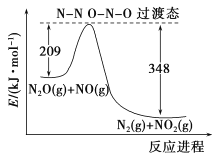
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求填空:
(1)写出下列物质的电子式:Na2O2_____NH3_____。
(2)2.2g铵根14N2H4+的中子数是___,核外电子数是____,某微粒含有一个原子核,核中有 17个质子,20个中子,核外有 18个电子,该粒子的化学符号是____。
(3)已知断开 1mol H—H 键、1mol I—I 键、1mol H—I 键分别需要吸收的能量为 436kJ、151kJ、299kJ,则由 1mol H2和 1mol I2生成 2mol HI会_____(“放出”或“吸收”)_____kJ 的热量。
(4)现有下列物质:①H2 ②Na2O2 ③NaOH ④H2O2 ⑤CaCl2 ⑥NH4NO3 ⑦H2S,只由离子键构成的物质是_____(填序号,同下),由离子键和共价键构成的物质是_________,属于共价化合物的是_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:2SiHCl3(g)=SiH2Cl2(g)+SiCl4(g) ΔH=Q kJ·mol-1,其平衡常数随温度变化如表所示:
温度/k | 323 | 343 | 400 |
平衡常数 | 0.01 | 0.02 | 1 |
在323K和343K时SiHCl3的转化率随时间变化的结果如图所示。
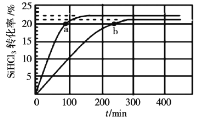
请回答下列问题:
(1)该反应的Q___0(填“>”或“<”)。
(2)代表323K曲线的是___(填a或b)
(3)在400K下,要缩短反应达到平衡的时间,可采取的措施有___、___。
(4)已知2SiHCl3(g)=SiH2Cl2(g)+SiCl4(g)的反应速率v=v正-v逆,其中v正=k正x2SiHCl3,v逆=k逆xSiH2Cl2xSiCl4,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,计算a处![]() =___。
=___。
(5)TK时在体积为10L的反应器中,通入一定量的SiH2Cl2(g)和SiCl4(g),发生上述反应,SiH2Cl2(g)和SiCl4(g)浓度变化如图所示,则0~4 min时平均反应速率v(SiCl4(g))=___。
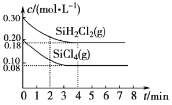
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是元素周期表的一部分,表中所列字母分别代表某一化学元素。回答问题:
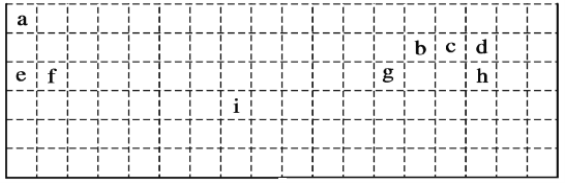
(1)表中的实线是元素周期表的部分边界,请在图中用实线补全元素周期表的边界。并注明金属非金属的分界线___。
(2)有人认为在元素周期表中,有一种元素也可以放在第ⅦA族,你认为该元素为___(填元素符号)。
(3)实验室制ca3的化学反应方程式为___。
(4)g的氧化物与e的最高价氧化物对应水化物反应的离子方程式为___。
(5)设计实验验证b、c非金属性的强弱,用离子方程式表示为___。
(6)i在周期表中的位置为___。i对应的单质与水反应的化学方程式为___。
(7)a2d2的电子式为___;用电子式表示fCl2的形成过程___。
(8)分别由a、d、e、h四种元素形成的两种盐反应的离子方程式为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】以下是某药物中间体L的合成路线:
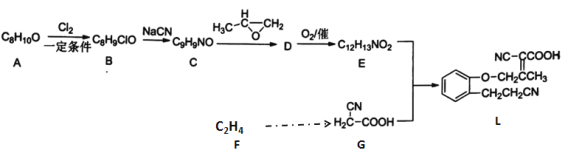
已知:
RCH2COOH![]()
请回答:
(1)有机物A的结构简式________。
(2) 下列说法不正确的是________。
A 有机物A转化成B的条件是铁粉作为催化剂
B 有机物C转化成D原子利用率可达100%
C 用铜丝蘸取有机物B放在酒精灯上灼烧,火焰显绿色
D 有机物D不能使酸性高锰酸钾溶液褪色
(3) E+G→L的化学方程式是________________。
(4) 写出符合下列条件的A的所有同分异构体__________________。
①含有苯环②核磁共振氢谱显示有4种氢原子
(5)设计以F 为原料合成G流程____________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】几种短周期元素的原子半径及主要化合价如下表:
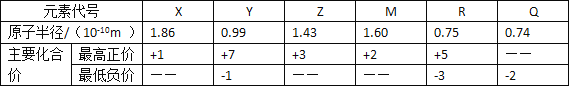
下列说法正确的是( )
A.离子半径:r(R3-)>r(X+)>r(Z3+)
B.元素X 和Q 形成的化合物中不可能含有共价键
C.Q2-比 R3-更容易失去电子
D.Y 的含氧酸酸性一定比 R 的含氧酸的酸性强
查看答案和解析>>
科目: 来源: 题型:
【题目】利用图示装置进行实验,不能得出相应结论的是( )
溶液① | 固体② | 溶液③ | 实验结论 |
| |
A | 稀硫酸 | Na2CO3 | Na2SiO3 | 非金属性:S>C>Si | |
B | 浓盐酸 | KMnO4 | Na2S | 氧化性:KMnO4>Cl2>S | |
C | 浓H2SO4 | Cu | 氢硫酸 | 溶液变浑浊 | |
D | 浓氨水 | CaO | AlCl3 | 可以制备Al(OH)3 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】ClO2代替漂白粉等含氯消毒剂可以减少对人体的危害,但ClO2不易储存和运输,因此将其制成亚氯酸钠。
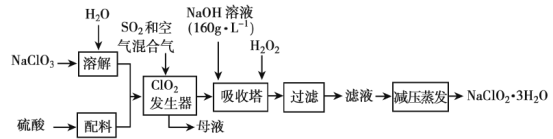
已知:①NaClO2的溶解度随温度升高而增大,温度过高易分解,适当条件下可结晶析出NaClO2·3H2O;
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下较安全;
(1)在发生器中鼓入空气的作用可能是___(填序号)。
A将SO2氧化成SO3,增强酸性
B稀释ClO2以防止爆炸
C将NaClO3氧化成ClO2
(2)提高“ClO2发生器”反应速率的措施有___。
(3)吸收塔内反应的离子方程式为___。
(4)采取“减压蒸发”而不用“常压蒸发”,原因是___。
(5)测定粗产品中亚氯酸钠的含量,实验如下:
a.准确称取所得亚氯酸钠样品mg于小烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应,将所得混合液配成250 mL待测溶液。(已知:ClO2-+4I-+4H+=2H2O+2I2+Cl-)
b.移取25.00mL待测溶液于锥形瓶中,加几滴淀粉溶液,用c mol·L-1Na2S2O3标准液滴定至终点,重复2次,测得平均值为V mL。(已知:I2+2S2O32-=2I-+S4O62-)
①达到滴定终点时的现象为___。
②该样品中NaClO2的质量分数为___(用含m、c、V的代数式表示,结果需化简)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com