
科目: 来源: 题型:
【题目】下列有机化合物对应类别的同分异构体数目最少的是(不考虑立体异构)
选项 | A | B | C | D |
分子式 | C9H12 | C5H12O | C4H8O2 | C4H8FCl |
类别 | 芳香烃 | 醇 | 酯 | 卤代烃 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】以硫铁矿(主要成分为FeS2,还有少量CuS、SiO2等杂质)为原料制备绿矾晶体(FeSO4·7H2O)的工艺流程如下:
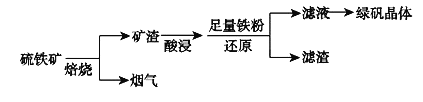
(1)烟气中的SO2会污染环境,可用足量氨水吸收,写出该反应的离子方程式___。
(2)检验滤液中金属阳离子所用试剂及现象为____、____。
(3)FeSO4溶液制备绿矾晶体过程中要保持H2SO4过量,理由___。(结合化学用语说明原因)
(4)燃料细菌脱硫法是用氧化亚铁硫杆菌(T.f)对硫铁矿进行催化脱硫,同时得到FeSO4溶液。其过程如图所示:
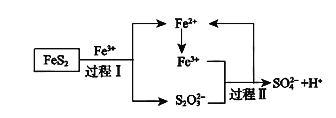
已知总反应为:FeS2+14Fe3++8H2O=2SO42-+15Fe2++16H+
①将过程I离子方程式补充完整
___FeS2+___Fe3++____=7Fe2++___S2O32-+___,__
②过程II反应的离子方程式____。
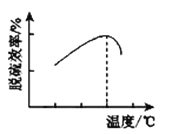
③研究发现,用氧化亚铁硫杆菌(T.f)脱硫,温度过高脱硫效率降低(如图),可能的原因是___。
(5)绿矾晶体在空气中易被氧化。取X g样品,加水完全溶解,用酸性KMnO4标准溶液滴定,终点现象为___;酸性KMnO4 溶液氧化Fe2+ 的离子方程式:____;配制酸性高锰酸钾溶液时下列操作将导致Fe2+的浓度偏大的是__。
a.定容时仰视 b.容量瓶洗涤后未干燥直接进行配制
c.定容摇匀后液面下降 d.未洗涤烧杯和玻璃棒
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)有下列几组物质,请将序号填入下列空格内:
A.CH2=CH-COOH和油酸(C17H33COOH) B.12C60和石墨
C.![]() 和
和 ![]() D.35Cl和37Cl E.乙醇和乙二醇
D.35Cl和37Cl E.乙醇和乙二醇
①互为同位素的是_____________;②互为同系物的是________________;
③互为同素异形体的是__________;④互为同分异构体的是_____________;
⑤既不是同系物,又不是同分异体,也不是同素异形体,但可看成是同一类物质的是____。
(2)写出下列有机物的系统命名或结构简式:
A. :________________________;
:________________________;
B.CH3CH(CH3)C(CH3)2(CH2)2CH3:_______________________;
C.3,4-二甲基-4-乙基庚烷:______________________________;
D.2-甲基-2-丁烯:_________________;
E.2,4,6-三硝基苯酚:___________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,对于恒容密闭容器中进行的可逆反应2NO2(g)![]() 2NO(g)+O2(g),下列说法中能说明反应一定已经达到化学平衡状态的是( )
2NO(g)+O2(g),下列说法中能说明反应一定已经达到化学平衡状态的是( )
①单位时间生成n mol O2的同时生成2n mol NO2;
②2v正(NO2)=v逆(O2)
③NO2、NO、O2的物质的量浓度之比为2:2:1;
④容器内压强不再改变
⑤密闭容器中混合气体的密度不再改变;
⑥混合气体的平均相对分子质量不再改变
A.①④⑥B.②③⑤C.①②⑥D.①③⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究小组欲探究SO2的化学性质,设计了如下实验方案。
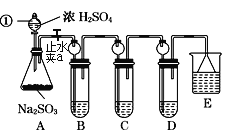
(1)指出仪器①的名称:___。
(2)装置B检验SO2的氧化性,则B中所盛试剂可以为___。
(3)装置C中盛装溴水用以检验SO2的___性,则C中反应的离子方程式为___。
(4)装置D中盛装新制漂白粉浓溶液,通入SO2一段时间后,D中出现了大量白色沉淀。同学们对白色沉淀成分提出三种假设:
①假设一:该白色沉淀为CaSO3;
假设二:该白色沉淀为___;
假设三:该白色沉淀为上述两种物质的混合物。
②基于假设一,同学们对白色沉淀成分进行了探究。设计如下方案:
限选的试剂:0.5mol·L-1HCl、0.5 mol·L-1H2SO4、0.5mol·L-1BaCl2、1mol·L-1NaOH、品红溶液。
第1步,将D中沉淀过滤、洗涤干净,备用。
请回答洗涤沉淀的方法:___。
第2步,用另一只干净试管取少量沉淀样品,加入___(试剂),塞上带导管的单孔塞,将导管的另一端插入盛有___的试管中。若出现固体完全溶解,出现气泡,且该溶液褪色现象,则假设一成立。
(5)装置E中盛放的试剂是__,作用是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】某元素的一个原子形成的离子可表示为![]() n-,下列说法正确的是( )
n-,下列说法正确的是( )
A.![]() n-中含有的中子数为a+b
n-中含有的中子数为a+b
B.![]() n-中含有的电子数为a-n
n-中含有的电子数为a-n
C.X原子的质量数为a+b+n
D.一个X原子的质量约为![]() g
g
查看答案和解析>>
科目: 来源: 题型:
【题目】如图中每一个方格表示有关的一种反应物或生成物,其中A、C为无色气体。

(1)写出有关物质的化学式X:___;F__。
(2)写出A→D的化学方程式___。
(3)写出实验室制备C的化学方程式___。
(4)分别取两份50mLNaOH溶液,各向其中通入一定量的气体A,随后各取溶液10mL分别将其稀释到相同体积,得到溶液甲和乙,分别向甲和乙中逐滴加入0.1mol/L的HCl溶液,产生的A气体体积(标准状况下)与所加入的HCl的体积之间的关系如图所示,试
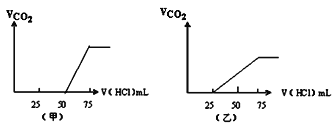
①NaOH在吸收A气体后,乙图所示溶液中存在的溶质是:___,其物质的量之比是:__。
②原NaOH溶液的物质的量浓度是___mol/L。
查看答案和解析>>
科目: 来源: 题型:
【题目】某高聚物的单体A(C11H12O2)可发生以下变化:

已知: C的烃基部分被取代生成的一氯代物D有两种;F的分子式为C7H8O,含有苯环,但与FeCl3溶液不显色。请回答:
(1)F分子中含有的官能团结构简式是__________________。
(2)由A生成B和F的反应类型为(选填序号)________。
①氧化反应 ②取代反应 ③水解反应 ④消去反应
(3)B的结构简式是_______________________。
(4)分子式为C7H8O,含有苯环的同分异构体除F外还有____________种。
(5)写出下列方程式
①由A生成B和F:_______________________________________;
② B → C:___________________________________________________;
③A在一定条件下生成高聚物:__________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】A、D、E、W是中学常见的四种元素,原子序数依次增大,A的原子最外层电子数是次外层的2倍,D的氧化物属于两性氧化物,D、E位于同周期,A、D、E的原子最外层电子数之和为14,W是人体必需的微量元素,缺乏W会导致贫血症状。
(1)W在元素周期表中的位置是___。A与E组成的化合物是常用的溶剂,写出其电子式___。
(2)下列事实能用元素周期表相应规律解释的是(填字母序号)___。
a.D的最高价氧化物对应水化物的碱性弱于Mg(OH)2
b.E的气态氢化物的稳定性小于HF
c.A的单质能与二氧化硅高温下制得粗品硅单质
(3)WE3的溶液可用于刻蚀铜制的印刷电路板,反应的离子方程式为____。
(4)①工业上用电解法制备D的单质,反应的化学方程式为___。
②家用“管道通”的有效成分是烧碱和D的单质,使用时需加入一定量的水,此时发生反应的化学方程式为____。
(5)W的单质可用于处理酸性废水中的NO3-,使其转换为NH4+,同时生成有磁性的W的氧化物X,再进行后续处理,上述反应的离子方程式为__。上述W的氧化物X能与D的单质反应,写出该反应的化学方程式为__。
查看答案和解析>>
科目: 来源: 题型:
【题目】具有解热镇痛及抗生素作用的药物“芬必得”主要成分的结构简式如图,它属于( )

①芳香族化合物 ②脂肪族化合物 ③有机羧酸 ④有机高分子化合物 ⑤芳香烃
A. ③⑤ B. ②③ C. ①③ D. ①④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com