
科目: 来源: 题型:
【题目】同温同压下,在3支相同体积的试管中分别充有等体积混合的2种气体,它们是① NO和NO2,② NO2和O2,③ NH3和N2。现将3支试管均倒置于水槽中,充分反应后,试管中剩余气体的体积分别为V1、V2、V3,则下列关系正确的是
A.V1>V2>V3B.V1>V3>V2C.V2>V3>V1D.V3>V1>V2
查看答案和解析>>
科目: 来源: 题型:
【题目】通过以下反应可获得新型能源二甲醚(![]() )。下列说法不正确的是
)。下列说法不正确的是
①![]()
![]()
②![]()
![]()
③![]()
![]()
④![]()
![]()
A. 反应①、②为反应③提供原料气
B. 反应③也是![]() 资源化利用的方法之一
资源化利用的方法之一
C. 反应![]() 的
的![]()
D. 反应![]() 的
的![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.2.0g H2O与![]() 的混合物中所含质子数为NA
的混合物中所含质子数为NA
B.46g NO2 和N2O4 混合气体中含有的原子数为 3NA
C.1L 0.1 molL-1 氨水中含有 0.1NA NH3 分子
D.![]() 与
与![]() 充分反应,转移电子数为3NA
充分反应,转移电子数为3NA
查看答案和解析>>
科目: 来源: 题型:
【题目】以黄铜矿(CuFeS2)、FeCl3和乳酸[CH3CH(OH)COOH]为原料可制备有机合成催化剂CuCl和补铁剂乳酸亚铁{[CH3CH(OH)COO]2Fe}。其主要实验流程如下:

(1) FeCl3溶液与黄铜矿发生反应的离子方程式为___________________________________________。
(2)向溶液1中加入过量铁粉的目的是_______________________________________________。
(3)过滤后得到的FeCO3固体应进行洗涤,检验洗涤已完全的方法是__________________________。

(4)实验室制备乳酸亚铁的装置如图所示。
①实验前通入N2的目的是_______________________________________。
②某兴趣小组用KMnO4滴定法测定样品中Fe2+含量进而计算产品中乳酸亚铁的质量分数,结果测得产品的质量分数总是大于100%,其原因可能是_______________________________________________。
(5)已知:
①CuCl为白色晶体,难溶于水和乙醇,在空气中易氧化;可与NaCl溶液反应,生成易溶于水的NaCuCl2。
②NaCuCl2可水解生成CuCl,温度、pH对CuCl产率的影响如图所示。


由CuCl(s)、S(s)混合物提纯CuCl的实验方案为:将一定量的混合物溶于饱和NaCl溶液中,________________________________________________________________________。(实验中须使用的试剂有:饱和NaCl溶液,0.1 mol·L-1 H2SO4、乙醇;除常用仪器外须使用的仪器有:真空干燥箱)。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O,如图所示,将少量试剂分别放入培养皿中的相应位置,实验时将浓盐酸滴在KClO3晶体上,并用表面皿盖好。下表中由实验现象得出的结论完全正确的是( )
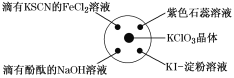
选项 | 实验现象 | 结论 |
A | 滴有KSCN的FeCl2溶液变红 | Cl2具有还原性 |
B | 滴有酚酞的NaOH溶液褪色 | Cl2具有酸性 |
C | 紫色石蕊溶液先变红后褪色 | Cl2具有漂白性 |
D | KI淀粉溶液变成蓝色 | Cl2具有氧化性 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】 [物质结构与性质]
臭氧(O3)在[Fe(H2O)6]2+催化下能将烟气中的SO2、NOx分别氧化为![]() 和
和![]() ,NOx也可在其他条件下被还原为N2。
,NOx也可在其他条件下被还原为N2。
(1)![]() 中心原子轨道的杂化类型为___________;
中心原子轨道的杂化类型为___________;![]() 的空间构型为_____________(用文字描述)。
的空间构型为_____________(用文字描述)。
(2)Fe2+基态核外电子排布式为__________________。
(3)与O3分子互为等电子体的一种阴离子为_____________(填化学式)。
(4)N2分子中σ键与π键的数目比n(σ)∶n(π)=__________________。
(5)[Fe(H2O)6]2+与NO反应生成的[Fe(NO)(H2O)5]2+中,NO以N原子与Fe2+形成配位键。请在[Fe(NO)(H2O)5]2+结构示意图的相应位置补填缺少的配体。
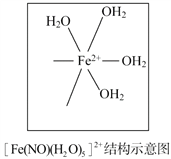
查看答案和解析>>
科目: 来源: 题型:
【题目】苯甲酸甲酯在NaBH4、ZnCl2等作用下可转化为醇,其中NaBH4转化为H3BO3:

(1)Zn2+基态核外电子排布式为_____。
(2)苯甲醇(![]() )中碳原子的杂化轨道类型为_____。
)中碳原子的杂化轨道类型为_____。
(3)1mol苯甲酸甲酯(![]() )分子中含有σ键的数目为_____mol。
)分子中含有σ键的数目为_____mol。
(4)与BH4﹣互为等电子体的阳离子为_____(填化学式),BH4﹣离子的空间构型为(用文字描述)_____。
(5)硼酸是一种层状结构白色晶体,层内的H3BO3分子通过氢键相连(如图所示)。1molH3BO3晶体中有_____mol氢键。

查看答案和解析>>
科目: 来源: 题型:
【题目】氟喹诺酮是人工合成的抗菌药,其中间体G的合成路线如下:

(1)G中的含氧官能团为_____和_____(填名称)。
(2)由C→D的反应类型是_____。
(3)化合物X(分子式为C3H7N)的结构简式为_____。
(4)B和乙醇反应的产物为H(C8H6FCl2NO2),写出满足下列条件的H的一种同分异构体的结构简式:_____。
Ⅰ.是一种α﹣氨基酸;
Ⅱ.分子中有4种不同化学环境的氢,且分子中含有一个苯环。
(5)根据已有知识并结合相关信息,写出以![]() 和ClMgCH(COOC2H5)2为原料制备
和ClMgCH(COOC2H5)2为原料制备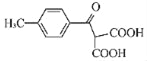 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)_____。
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,用化学用语回答下列问题:
ⅠA | 0 | ||||||||
1 | ① | ⅡA | …… | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | |||||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||||
4 | ⑨ | ||||||||
(1)②元素简单氢化物的电子式是________________________。
(2)③、④、⑤、⑦元素的离子半径由大到小的顺序为______________。
(3)⑥元素的名称为_______________,举出⑥单质的一个应用____________。
(4)上述所有元素中最高价氧化物对应的水化物的酸性最强的是_____________, 写出一个能证明⑧比⑦非金属性强的一个离子反应方程式___________________。
(5)有两种化合物A和B都由①③④⑦四种元素组成。若A与B在水溶液中能发生离子反应,则该反应的离子方程式为____________。
(6)⑨与④的原子序数之差为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】丹参醇是存在于中药丹参中的一种天然产物。合成丹参醇的部分路线如下:
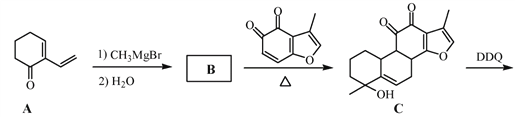
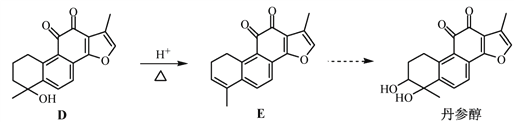
已知:![]()
(1)A中的官能团名称为__________________(写两种)。
(2)D![]() E的反应类型为__________________。
E的反应类型为__________________。
(3)B的分子式为C9H14O,写出B的结构简式:__________________。
(4)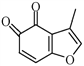 的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:_________。
的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:_________。
①分子中含有苯环,能与FeCl3溶液发生显色反应,不能发生银镜反应;
②碱性条件水解生成两种产物,酸化后分子中均只有2种不同化学环境的氢。
(5)写出以![]() 和
和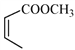 为原料制备
为原料制备![]() 的合成路线流程图(无机试剂和乙醇任用,合成路线流程图示例见本题题干)。
的合成路线流程图(无机试剂和乙醇任用,合成路线流程图示例见本题题干)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com