
科目: 来源: 题型:
【题目】(1)基态溴原子的价层电子轨道排布式为________,第四周期中,与溴原子未成对电子数相同的金属元素有 ______种。
(2)铍与铝的元素性质相似。下列有关铍和铝的叙述正确的有_________(填标号)。
A.都属于p区主族元素 B.电负性都比镁大
C.第一电离能都比镁大 D.氯化物的水溶液pH均小于7
(3)OF2分子中,O的杂化类型为______,与下列微粒的中心原子杂化方式相同且空间构型也与OF2相同的是_______(填字母), OF2分子VSEPR模型的名称为__________
A.PCl3 B.SO3 C. NH2- D.NO3-
(4)P元素有白磷、红磷、黑磷三种常见的单质。
①白磷(P4)易溶于CS2,难溶于水,原因是_____________________________________________。
②黑磷是一种黑色有金属光泽的晶体,是一种比石墨烯更优秀的新型材料。白磷、红磷都是分子晶体,黑磷晶体与石墨类似的层状结构,如图所示。下列有关黑磷晶体的说法正确的是_______。

A.黑磷晶体中磷原子杂化方式为sp2杂化
B.黑磷晶体中层与层之间的作用力是分子间作用力
C.黑磷晶体的每一层中磷原子都在同一平面上
D.P元素三种常见的单质中,黑磷的熔沸点最高
(5)磷化硼(BP)是受到高度关注的耐磨材料,它可用作金属表面的保护层。其晶胞与金刚石相似,其中B原子处于晶胞体内,P原子处于晶胞表面。
①磷化硼晶体属于_____晶体(填晶体类型),_____ (填“是”或“否”)含有配位键。
③已知BP的晶胞中最近的B与P原子核间距为a nm,NA为阿伏加德罗常数的数值,则磷化硼晶体的密度表达式为________________g·cm-3(用含a、NA的式子表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室有一未知浓度的盐酸,某同学在实验室中进行实验测定盐酸的浓度。请完成下列填空:
配制100mL0.10molL-1NaOH标准溶液。需用托盘天平称量___g的氢氧化钠固体。
取20.00mL待测盐酸放入锥形瓶中,并滴加 2~3滴酚酞作指示剂,用配制的标准 NaOH溶液进行滴定。重复上述滴定操作 2~3次,记录数据如下:
滴定次数 | 待测盐酸的体积/mL | 0.10 mol/L NaOH 溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
第一次 | 20.00 | 2.00 | 28.15 |
第二次 | 20.00 | 1.50 | 29.50 |
第三次 | 20.00 | 0.20 | 26.55 |
①该实验滴定达到终点的标志是_________
②根据上述数据,可计算出该盐酸的浓度约为______。(保留两位有效数字)
③在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有_______。(双选)
A 滴定终点读数时俯视读数 B 酸式滴定管使用前,水洗后未用待测盐酸润洗
C 锥形瓶水洗后未干燥 D 碱式滴定管尖嘴部分有气泡,滴定后消失
E 称量NaOH 固体时,混入少量KOH杂质
④现用以上实验配制的0.10molL-1NaOH溶液滴定未知浓度的CHCOOH溶液,反应恰好完全时,下列叙述中正确的是_____
A 溶液呈中性,可选用甲基橙或酚酞作指示剂
B 溶液呈中性,只能选用石蕊作指示剂
C 溶液呈碱性,可选用甲基橙或酚酞作指示剂
D 溶液呈碱性,只能选用酚酞作指示剂
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应中的能量转化不正确的是( )
选项 | 化学反应 | 能量转化形式 |
A | CH4+2O2 | 化学能转化成热能 |
B | Pb+PbO2+2H2SO4 | 使用时放电,电能转化成化学能 |
C | mH2O+nCO2 | 光能转化成化学能 |
D | CaCO3 | 热能转化成化学能 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放显减少10%,二氧化碳(CO2)的排放量也要大幅减少。
①已知反应:NO2(g)+SO2(g)![]() SO3(g)+NO(g),一定条件下,将NO2与SO2以体积比1∶2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是____(填字母)。
SO3(g)+NO(g),一定条件下,将NO2与SO2以体积比1∶2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是____(填字母)。
A.体系压强保持不变
B.混合气体颜色保持不变
C.混合气体的平均相对分子质量不再变化
D.每消耗1molSO3的同时生成1 molNO2
②CO2可转化成有机物 CH3OH实现碳循环。在1L的密闭容器中,充入lmolCO2和 3molH2,一定条件下反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g),从反应开始到平衡,用氢气浓度变化表示的平均反应速率v(H2)=_______
CH3OH(g)+H2O(g),从反应开始到平衡,用氢气浓度变化表示的平均反应速率v(H2)=_______

③工业上,CH3OH 也可由CO和H2合成。参考合成反应CO(g)+2H2(g)![]() CH3OH(g)的平衡常数。下列说法正确的是_____。(双选)
CH3OH(g)的平衡常数。下列说法正确的是_____。(双选)
温度/℃ | 0 | 100 | 200 | 300 | 400 |
平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
A.该反应正反应是放热反应
B.该反应在低温下不能自发进行,高温下可自发进行
C.在T℃时,1L密闭容器中投入0.1molCO和 0.2molH2,达到平衡时,CO转化率为 50%,则此时的平衡常数为100
D.工业上采用稍高的压强(5MPa)和250℃,是因为此条件下,原料气转化率最高
(2)以NH3与CO2为原料可以合成尿素[CO(NH2)2],涉及的化学反应如下:
反应I:2NH3(g)+CO2(g)![]() NH2CO2NH4(s) ΔH1=159.5 kJ·mol1;
NH2CO2NH4(s) ΔH1=159.5 kJ·mol1;
反应II:NH2CO2NH4(s)![]() CO(NH2)2(s)+H2O(g) ΔH2=+116.5 kJ·mol1;
CO(NH2)2(s)+H2O(g) ΔH2=+116.5 kJ·mol1;
![]() H2O(g) ΔH3=+44.0 kJ·mol1。
H2O(g) ΔH3=+44.0 kJ·mol1。
则反应IV:NH3与CO2合成尿素同时生成液态水的热化学方程式为_________。
(3)T1℃时,向容积为2L的恒容密闭容器中充入n(NH3)∶n(CO2)=2∶1的原料气,使之发生反应IV,反应结束后得到尿素的质量为30g,容器内的压强(p)随时间(t)的变化如图1所示。(M(尿素)=60g/mol)
①T1℃时,该反应的平衡常数K的值为______。


②图2中能正确反映平衡常数K随温度变化关系的曲线为____(填曲线标记字母)
查看答案和解析>>
科目: 来源: 题型:
【题目】可逆反应mA(固)+nB(气)![]() pC (气)+qD(气)反应过程中其他条件不变时C的百分含量C%与温度(T)和压强(p)的关系如图所示,下列叙述中正确的是( )
pC (气)+qD(气)反应过程中其他条件不变时C的百分含量C%与温度(T)和压强(p)的关系如图所示,下列叙述中正确的是( )

A. 平衡后,使用催化剂,C%将增大
B. 平衡后,增加A的量有利于化学平衡向正反应方向移动
C. 方程式中n>p+q
D. 平衡后,升温,平衡向逆反应方向移动
查看答案和解析>>
科目: 来源: 题型:
【题目】可逆反应2SO2+ O2![]() 2SO3达到平衡的标志是
2SO3达到平衡的标志是
①消耗2 mol SO2的同时生成2 mol SO3
② SO2、O2与SO3的物质的量之比为2∶1∶2
③反应混合物中,SO3的质量分数不再改变
A.①②B.①③C.只有③D.只有①
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下的恒容容器中,对可逆反应2SO2(g)+O2(g)![]() 2SO3(g),下列叙述中,能说明反应已达到化学平衡状态的是( )
2SO3(g),下列叙述中,能说明反应已达到化学平衡状态的是( )
①单位时间内断裂a mol O=O键,同时生成2a mol SO3②SO2生成的速率与SO3分解的速率相等③容器内的压强不再变化④混合气体的物质的量不再变化⑤混合气体的平均相对分子质量不再变化⑥混合气体的密度不再变化
A. ②③④B. ②④⑥C. ③④⑤D. ①②④
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)燃煤发电厂常利用反应2CaCO3(s)+2SO2(g)+O2(g)=2CaSO4(s)+2CO2(g);ΔH=-681.8kJ·mol1对煤进行脱硫处理来减少SO2的排放。对于该反应,在T℃时,借助传感器测得反应在不同时间点上各物质的浓度如下:
时间/min 浓度/mol·L1 | 0 | 10 | 20 | 30 | 40 | 50 |
O2 | 1.00 | 0.79 | 0.60 | 0.60 | 0.64 | 0.64 |
CO2 | 0 | 0.42 | 0.80 | 0.80 | 0.88 | 0.88 |
①0~10min内,平均反应速率v(O2)=___________;②30min后,只改变某一条件,反应重新达到平衡。根据上表中的数据判断,改变的条件可能是____________(填字母)。
A.加入一定量的粉状碳酸钙B.通入一定量的O2
C.适当缩小容器的体积 D.加入合适的催化剂
(2)NOx的排放主要来自于汽车尾气,有人利用反应C(s)+2NO(g) ![]() N2(g)+CO2(g)ΔH=-34.0kJ·mol1,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:
N2(g)+CO2(g)ΔH=-34.0kJ·mol1,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:
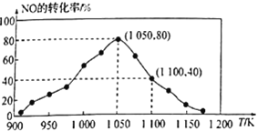
由图可知,1050K前反应中NO的转化率随温度升髙而增大,其原因为___________,在1050K、1.1×106Pa时,该反应的化学平衡常数Kp=___________(已知:气体分压(P分)=气体总压(Pa)×体积分数)
(3)为避免汽车尾气中的有害气体对大气的污染,需给汽车安装尾气净化装置。在净化装置中CO和NO发生反应2NO(g)+2CO(g)![]() N2(g)+2CO2
N2(g)+2CO2
①达到平衡后,仅升高温度,k正增大的倍数____________ (填“>”“<”或“=”)k逆增大的倍数。
②若在1L的密闭容器中充入1mol CO和1mol NO,在一定温度下达到平衡时,CO的转化率为40%,则![]() = ____________。
= ____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,通过下列反应可实现燃煤烟气中硫的回收:SO2(g)+2CO(g)![]() 2CO2(g)+S(s) ΔH<0,若反应在恒容的密闭容器中进行,下列有关说法正确的是( )
2CO2(g)+S(s) ΔH<0,若反应在恒容的密闭容器中进行,下列有关说法正确的是( )
A. 平衡前,随着反应的进行,容器内压强始终不变
B. 平衡时,若升高温度,CO体积分数增大,平衡常数变小
C. 平衡时,其他条件不变,分离出CO2,正反应速率加快
D. 平衡时,v正(SO2)=2v逆(CO)
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A、B、C和甲、乙、丙均是由短周期元素形成的物质,D是过渡元素形成的常见单质,它们之间能发生如下反应。(图中有些反应的产物和反应条件没有标出)

请根据以上信息回答下列问题:
(1)写出下列物质的化学式
A________、B_______、C_______、F________、 H_____________、乙_________
(2)写出下列反应的离子方程式:④_____________⑤___________
(3)金属D与稀硫酸反应,产生标准状况下1.12L的H2气体,则参加反应的硫酸为_______mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com