
科目: 来源: 题型:
【题目】如图所示,图Ⅰ是恒压密闭容器,图Ⅱ是恒容密闭容器.当其它条件相同时,在Ⅰ、Ⅱ中分别加入2molX和2molY,开始时容器的体积均为VL,发生如下反应并达到平衡状态(提示:物质X、Y的状态均未知,物质Z的状态为气态):2X(?)+Y(?)aZ(g)此时Ⅰ中X、Y、Z的物质的量之比为1:3:2。下列判断正确的是( )

A.物质Z的化学计量数a=2
B.若Ⅱ中气体的密度如图Ⅲ所示,则X、Y中只有一种为气态
C.若X、Y均为气态,则在平衡时X的转化率:Ⅰ<Ⅱ
D.若X为固态、Y为气态,则Ⅰ、Ⅱ中从开始到平衡所需的时间:Ⅰ>Ⅱ
查看答案和解析>>
科目: 来源: 题型:
【题目】2018年10月15日,中国用“长征三号乙”运载火箭成功以“一箭双星”方式发射北斗三号全球组网卫星系统第15、16号卫星,其火箭推进剂为高氯酸铵(NH4ClO4)等。制备NH4ClO4的工艺流程如下:
饱和食盐水![]() NaClO3
NaClO3![]() NaClO4
NaClO4![]() NaClO4
NaClO4![]() NH4ClO4
NH4ClO4
下列说法错误的是( )
A. NH4ClO4属于离子化合物
B. 溶解度:NaClO4>NH4ClO4
C. 该流程中可循环利用的物质是NH4Cl
D. 高氯酸铵中氯元素的化合价为+7价
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关说法正确的是( )
A. 苯酚钠溶液中通入少量的二氧化碳,产物是苯酚和碳酸钠
B. 苯的同系物中,苯环和侧链相互影响,使得二者均易被氧化
C. ![]() 在核磁共振氢谱中出现两组峰,其氢原子数之比为3∶2
在核磁共振氢谱中出现两组峰,其氢原子数之比为3∶2
D. 苯甲酸、苯乙烯分子中的所有原子可能处于同一平面
查看答案和解析>>
科目: 来源: 题型:
【题目】近年来,镁在汽车、航空、航天、机械制造、军事等产业中应用迅猛发展。
(1)写出工业上冶炼金属镁的化学方程式__。
(2)某研究性小组探究以镁条、铝片为电极,稀氢氧化钠溶液为电解质溶液构成的原电池(如图所示),刚开始时发现电表指针向左偏转,镁条作负极,且镁条附近出现浑浊;但随后很快指针向右偏转,铝条溶解。
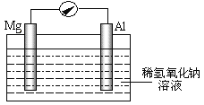
①开始阶段,镁条发生的电极反应式为__,指出其反应类型为__(填“氧化”或“还原”)。
②随后阶段,铝片发生的电极反应式为__。
查看答案和解析>>
科目: 来源: 题型:
【题目】高能LiFePO4电池,多应用于公共交通。电池中间是聚合物的隔膜, 主要作用是在反应过程中只让Li+通过。结构如图所示。

原理如下:(1-x)LiFePO4+xFePO4+LixCn![]() LiFePO4+nC。
LiFePO4+nC。
下列说法不正确的是( )
A. 放电时,正极电极反应式:xFePO4+xLi++xe-===xLiFePO4
B. 放电时,电子由负极经导线、用电器、导线到正极
C. 充电时,阴极电极反应式:xLi++xe-+nC===LixCn
D. 充电时,Li+向左移动
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A是来自石油的重要有机化工原料,E是具有果香味的有机物,F是一种高聚物,可制成多种包装材料。根据如图转化关系完成下列各题:

(1)A的分子式是__,C的名称是__,F的结构简式是__。
(2)D分子中的官能团名称是__,请设计一个简单实验来验证D物质存在该官能团,其方法是__。
(3)写出反应②的化学方程式并指出③的反应类型:
反应②:__;反应③类型是__反应。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关如图所示的说法正确的是
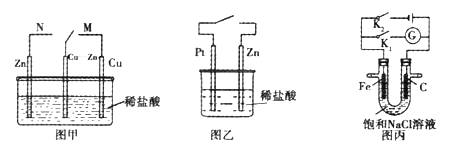
A. 图甲中开关置于N处时铜锌合金腐蚀的速率增大
B. 图乙中接通开关时,锌腐蚀的速率增大,锌上放出气体的速率增大
C. 图丙中接通K2时铁棒不被腐蚀,属于牺牲阳极保护法
D. 图丙中接通K1时,石墨棒周围溶液的pH增大
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A. 烷烃的通式为CnH2n+2,随n值增大,碳元素的质量百分含量逐渐减小
B. 乙烯与溴加成反应的产物为溴乙烷
C. 1 mol苯恰好与3 mol氢气完全加成,说明苯分子中有三个碳碳双键
D. 当n=7,主链上有5个碳原子的烷烃共有5种
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下图所示实验回答下列问题:

(1)装置A中试管内发生反应的化学方程式是_________________________________。
(2)根据装置B中的现象可以证明SO2具有__________性,反应一段时间后,将装置B中试管加热,可以观察到_______________________。
(3)装置C中试管口的棉花团上发生反应的离子方程式为________________________。
(4)如果将装置B换成装置D,并从直立导管中向氯化钡溶液中通入另一种气体,产生白色沉淀,则这种气体可能是_________________(填一种即可)。
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.25℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11` | 3.0×10-8 |
请回答下列问题:
(1)写出碳酸的第一级电离方程式:________。
(2)物质的量浓度相同的三种溶液:a.CH3COONa b.NaHCO3 c.NaClO
三种溶液的pH由小到大排列的顺序是___<___< ___(用编号填写)
(3)写出向NaClO溶液中通入少量CO2的化学方程式________。
Ⅱ.(4)碳酸钠溶液呈碱性的原因是:______。(写出离子方程式)。0.01mol/L Na2CO3溶液的pH____0.1mol/LNa2CO3溶液的pH。(填“>”或“<”或“==”)
(5)浓度均为0.1mol/L的①CH3COONa溶液②NH4Cl溶液③稀HCl④Na2SO4溶液按pH由大到小的排列顺序为____
(6)打开无水FeCl3的试剂瓶,常冒出许多“白烟”,发生反应的化学方程式为________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com