
科目: 来源: 题型:
【题目】硫酰氯(SO2Cl2)常用于制造医药品,染料等。某化学小组在实验室利用纯净干燥的氯气和二氧化硫反应制取硫酰氯,所需实验装置如图所示(部分装置略)。
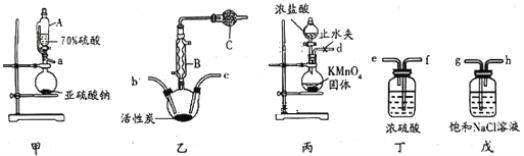
已知:①硫酰氯通常条件下为无色液体,熔点为-54.1℃,沸点为69.1℃,在潮湿的空气中“发烟”;
②SO2(g)+Cl2(g)=SO2Cl2(l),△H=-97.3kJ/mol。
(1)仪器A为恒压分液漏斗,与普通分液漏斗相比,其优点是___;仪器B的名称是___。
(2)上述装置的连接顺序:a接 , 接 , 接 , 接 , 接d。(装置可以重复使用)___
(3)球形干燥管C中的试剂为___,作用为___。
(4)硫酰氯在潮湿空气中“发烟”的原因是___(用化学方程式表示)
(5)在无活性炭存在的条件下SO2与Cl2也可发生反应,现将SO2、Cl2按照一定比例通入水中,请设计一个最简单的实验方案验证二者是否恰好完全反应:____。(简要描述实验操作,现象和结论)仪器自选,可供选择的试剂:酸性高锰酸钾溶液、碘化钾溶液、淀粉溶液、品红溶液。
查看答案和解析>>
科目: 来源: 题型:
【题目】硼化钒(VB2)—空气电池是目前储电能力最高的电池,电池示意图:
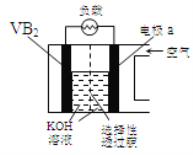
该电池工作时反应为:4VB2+ 11O2 = 4B2O3+ 2V2O5。下列说法正确的是
A.VB2极发生的电极反应为:2VB2+ 22OH-22e=V2O5+ 2B2O3+ 11H2O
B.电极a为电池负极
C.电流由VB2极经负载流向电极a
D.图中选择性透过膜允许阳离子选择性透过
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:2X(g)+Y(g)2Z(s) △H= -M kJ·mol-1。T℃,将2 mol X(g)和1 mol Y(g)加入体积为1L的恒容密闭容器中进行反应, 10 min后达到平衡,生成0.2 mol Z,共放出热量N kJ,下列说法不正确的是
A.其他条件不变,压缩容器,逆反应速率不变
B.在10 min内,X的反应速率为0.02 mol·L-1·min-l
C.在5 min末,X、Y的转化率不相等
D.在0~10 min内,Y的反应速率为![]() mol·L-1·min-l
mol·L-1·min-l
查看答案和解析>>
科目: 来源: 题型:
【题目】绿色化学的核心是反应过程的绿色化,即要求原料物质中的所有原子完全被利用且全部转入期望的产品中,下列过程不符合这一思想的是
A.甲烷、CO合成乙酸乙酯:2CH4+2CO![]() CH3COOCH2CH3
CH3COOCH2CH3
B.烯烃与水煤气发生的羰基合成反应:RCH═CH2+CO+H2![]() RCH2CH2CHO
RCH2CH2CHO
C.葡萄糖在酒化酶作用下转化为酒精:C6H12O6![]() 2C2H5OH+2CO2↑
2C2H5OH+2CO2↑
D.工业制取乙醛的方法之一:CH≡CH+H2O![]() CH3CHO
CH3CHO
查看答案和解析>>
科目: 来源: 题型:
【题目】为了证明一水合氨(NH3H2O)是弱电解质,常温下做以下实验没有意义的是
A.用pH试纸测得0.010 mol/L氨水的pH为10
B.用pH试纸测得0.10mol/L NH4Cl溶液的pH<7
C.比较浓度均为 0.1 mol·L-1NaOH溶液和氨水的导电能力
D.取10mL 0.010mol/L氨水,滴入2滴酚酞,显粉红色,再滴加少量稀盐酸,颜色变浅
查看答案和解析>>
科目: 来源: 题型:
【题目】可逆反应:2NO2 2NO + O2 (NO2为红棕色气体,其余气体无色)在恒温恒容密闭容器中进行,达到限度的标志是
① 单位时间内生成n mol O2的同时生成2n mol NO2
② v正(NO)=v逆(O2)
③ 混合气体的平均相对分子质量不再改变的状态
④ 混合气体的颜色不再改变的状态
⑤ 混合气体的密度不再改变的状态
⑥ 混合气体的压强不再改变的状态
⑦ 用NO2与NO、O2表示的反应速率之比为2:2:1的状态
A.①③④⑥B.②③⑤⑦C.①③④⑤D.①②⑤⑦
查看答案和解析>>
科目: 来源: 题型:
【题目】某烷烃 X分子中碳与氢的质量比为 36∶7。现取两支试管,分别加入适量溴水,实验操作及现象如下:

有关 X 的说法正确的是
A.相同条件下,X 的密度比水大
B.X的分子式为C6H14,X的同分异构体共有 6 种
C.X 能与 Br2发生加成反应使溴水褪色
D.试验后试管 2 中的有机层是上层还是下层,可通过加水确定
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)苏丹红颜色鲜艳、价格低廉,常被一些企业非法作为食品和化妆品等的染色剂,严重危害人们健康。苏丹红常见有Ⅰ、Ⅱ、Ⅲ、Ⅳ4种类型,苏丹红Ⅰ的分子结构如图1所示。


苏丹红Ⅰ在水中的溶解度很小,微溶于乙醇,有人把羟基取代在对位形成图2所示的结构,则其在水中的溶解度会____(填“增大”或“减小”),原因是__________________。
(2)Co(NH3)5BrSO4可形成两种钴的配合物,已知Co3+的配位数是6,为确定钴的配合物的结构,现对两种配合物进行如下实验:在第一种配合物的溶液中加BaCl2溶液时,产生白色沉淀;在第二种配合物溶液中加入BaCl2溶液时,则无明显现象,则第一种配合物的结构式为__________,第二种配合物的结构式为_____。
(3)Ag+能与NH3、S2O32-、CN等形成配位数为2的配合物。
利用AgNO3和氨水可配制[Ag(NH3)2]OH溶液,在[Ag(NH3)2]OH中存在的化学键的类型有_____(填字母)。
A 离子键 B 金属键 C 配位键 D 非极性键 E 极性键
(4)NO3-中N原子的杂化轨道类型是____,空间构型为_____。写出一种与NO2-,SO2互为等电子体的短周期元素单质分子的化学式_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】1915年诺贝尔物理学奖授予Henry Bragg和Lawrence Bragg,以表彰他们用X射线对晶体结构的分析所作的贡献。科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如图,其中配位键和氢键均釆用虚线表示。

(1)写出基态Cu原子的核外电子排布式____,S原子的价层电子排布图______
(2)写出胆矾晶体中水合铜离子的结构简式_____(必须将配位键表示出来)。
(3)向CuSO4溶液中滴加氨水,可以得到深蓝色的溶液,再加入乙醇后析出深蓝色晶体,写出深蓝色晶体的化学式_____。比较NH3和[Cu(NH3)4]2+中H-N-H 中键角的大小:NH3_____[Cu(NH3)4]2+(填“![]() ” “
” “![]() ” 或“=”)。
” 或“=”)。
(4)已知H2O2的结构如图:

H2O2分子不是直线形的,两个H原子犹如在半展开的书的两面纸上,书页角为93°52′,而两个O—H键与O—O键的夹角均为96°52′,估计它难溶于CS2,简要说明原因______。
(5)分析下表中两种物质的键能数据(单位:kJ/mol)。
A—B | A=B |
| |
CO | 357.7 | 798.9 | 1 071.9 |
N2 | 154.8 | 418.4 | 941.7 |
结合数据说明CO比N2活泼的原因:_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com