
科目: 来源: 题型:
【题目】某学习小组在实验室制取乙酸乙酯的主要步骤如下:
①配制2mL浓硫酸、3mL乙醇(含18O)和2mL乙酸的混合溶液。
②按如图连接好装置并加入混合液,用小火均匀加热3~5min。

③待试管乙收集到一定量产物后停止加热,撤出试管乙用力振荡,然后静置待分层。
④分离出乙酸乙酯,洗涤、干燥。
回答问题:
(1)配制混合液的操作顺序是___。
(2)装置中球形干燥管,除起冷凝作用外,另一重要作用是___。
(3)步骤②安装好实验装置,加入药品前还应检查___。
(4)写出实验中加热试管的目的:①___;②___。
(5)反应中浓硫酸的作用是__;写出能表示18O位置的制取乙酸乙酯的化学方程式:___。
(6)上述实验中饱和碳酸钠溶液的作用是__。(填字母)
A.反应掉乙酸和乙醇
B.反应掉乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中的更小,有利于分层析出
D.加速酯的生成,提高其产率
(7)步骤③所观察到的现象是___,从试管乙中分离出乙酸乙酯的实验操作名称是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.现代工业常以氯化钠为原料制备纯碱,部分工艺流程如图:

已知NaHCO3在低温下溶解度较小。
(1)反应Ⅰ的化学方程式为______。
(2)处理母液的两种方法:
①向母液中加入石灰乳,反应的化学方程式为____,目的是使____循环利用。
②向母液中____并降温,可得到NH4Cl晶体。
Ⅱ.某化学小组模拟“侯氏制碱法”,以NaCl、NH3、CO2和水等为原料以及如图所示装置制取NaHCO3,然后再将NaHCO3制成Na2CO3。

(3)装置丙中冷水的作用是______;由装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有______、洗涤、灼烧。
(4)若灼烧的时间较短,NaHCO3将分解不完全,该小组对一份加热了t1 min的NaHCO3 样品的组成进行了以下探究。
取加热了t1min的NaHCO3样品29.6g完全溶于水制成溶液,然后向此溶液中缓慢地滴加稀盐酸,并不断搅拌。随着盐酸的加入,溶液中有关离子的物质的量的变化如图所示。曲线c对应的溶液中的离子是____(填离子符号);该样品中NaHCO3和Na2CO3的物质的量分别是___mol、___mol。
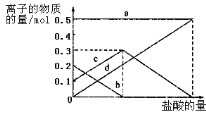
查看答案和解析>>
科目: 来源: 题型:
【题目】芳香族化合物X和Y都是从樟脑科植物中提取的香料。X可按下列路线合成Y。

已知:RCH=CHR′![]() RCHO+R′CHO
RCHO+R′CHO
2HCHO![]() HCOOH+CH3OH
HCOOH+CH3OH
(1)X的官能团名称为________;
(2)Y的结构简式为________;
(3)写出下列反应方程式:
X→G的第①步反应___________________;
E→F___________________;
(4) G的一种同分异构体H的结构简式为![]() ,写出以
,写出以![]() 为有机原料,制取H的合成路线(仿照下面路线,写清相应反应条件,无机物自选)。
为有机原料,制取H的合成路线(仿照下面路线,写清相应反应条件,无机物自选)。
 →____________________。
→____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】碳酸镁晶体是一种新型吸波隐形材料中的增强剂。
实验一:合成碳酸镁晶体的步骤:
①配制一定浓度的MgSO4溶液和NH4HCO3溶液;
②量取一定量的NH4 HCO3溶液于容器中,搅拌并逐滴加入MgSO4溶液,控制温度50℃,反应一段时间;
③用氨水调节溶液pH至9.5,放置一段时间后,过滤、洗涤、干燥得碳酸镁晶体产品。
称取3.000gMgSO4样品配制250mL溶液流程如图所示:

回答下列问题:
(1)写出实验仪器名称:A_____;B_____。配制溶液过程中定容后的“摇匀”的实验操作为______。
(2)检验碳酸镁晶体是否洗干净的方法是_________。
实验二:测定产品MgCO3·nH2O中的n值(仪器和药品如图所示):
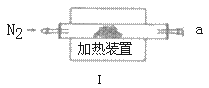
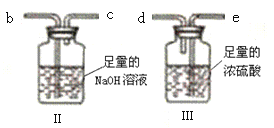
(3)实验二装置的连接顺序为_____(按气流方向,用接口字母abcde表示),其中Ⅱ装置的作用是_____。
(4)加热前先通入N2排尽装置Ⅰ中的空气,然后称取装置Ⅱ、Ⅲ的初始质量。进行加热时还需通入N2的作用是______。
(5)若要准确测定n值,至少需要下列所给数据中的_____(填选项字母),写出相应1种组合情景下,求算n值的数学表达式:n=______。
a.装置Ⅰ反应前后质量差m1 b.装置Ⅱ反应前后质量差m2 c.装置Ⅲ反应前后质量差m3
查看答案和解析>>
科目: 来源: 题型:
【题目】无水MgBr2可用作催化剂。实验室采用镁屑与液溴为原料制备无水MgBr2,装置如图1,主要步骤如下:

图1 图2
步骤1、三颈瓶中装入10g镁屑和150mL无水乙醚;装置B中加入15mL液溴;
步骤2、缓慢通入干燥的氮气,直至溴完全导入三颈瓶中;
步骤3、反应完毕后恢复至常温,过滤,滤液转移至另一干燥的烧瓶中,冷却至0℃,析出晶体,再过滤得三乙醚合溴化镁粗品;
步骤4、室温下用苯溶解粗品,冷却至0℃,析出晶体,过滤,洗涤得三乙醚合溴化镁,加热至160℃分解得无水MgBr2产品。
已知:①Mg与Br2反应剧烈放热;MgBr2具有强吸水性;
②MgBr2+3C2H5OC2H5![]() MgBr23C2H5OC2H5
MgBr23C2H5OC2H5
请回答:
(1)仪器A的名称是______;
(2)实验中不能用干燥空气代替干燥N2,原因是______________;
(3)步骤3中,第一次过滤除去的物质是_________________;
(4)有关步骤4的说法,正确的是__________________;
A.可用95%的乙醇代替苯溶解粗品 B.洗涤晶体可选用0℃的苯
C.加热至160℃的主要目的是除去苯 D.该步骤的目的是除去乙醚和可能残留的溴
(5)为测定产品的纯度,可用EDTA(简写为Y)标准溶液滴定,反应的离子方程式:Mg2++Y4﹣═MgY2
①滴定管洗涤前的操作是_______________________;
②测定时,先称取0.2500g无水MgBr2产品,溶解后,用0.0500molL﹣1的EDTA标准溶液滴定至终点,消耗EDTA标准溶液25.00mL,则测得无水MgBr2产品的纯度是__________(以质量分数表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】羰基硫(COS)广泛存在于以煤为原料的各种化工原料气中,能引起催化剂中毒、化学产品质量下降和大气污染。
(1)羰基硫的水解反应和氢解反应是两种常用的脱硫方法:
水解反应:COS(g)+H2O(g)![]() H2S(g)+CO2(g) △H=-34kJ/mol
H2S(g)+CO2(g) △H=-34kJ/mol
氢解反应:COS(g)+H2(g) ![]() H2S(g)+CO(g) △H=+7kJ/mol。
H2S(g)+CO(g) △H=+7kJ/mol。
已知:2H2(g)+O2(g)=2H2O(g) △H=-484kJ/mol。
写出表示CO燃烧热的热化学方程式:______________。
(2)氢解反应达到平衡后,保持体系的温度和总压强不变,通入适量的He,正反应速率____(填“增大”“减小”或“不变”,下同),COS的转化率_______。
(3)某温度下,向体积为2L的恒容密闭容器中通入2molCOS(g)和4molH2O(g),发生水解反应,5min后反应达到平衡,测得COS(g)的转化率为75%。
回答下列问题:
①反应从起始至5min内,v(H2S)=_______mol·L-1·min-1。
②该温度下,上述水解反应的平衡常数K=____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】臭氧是一种强氧化剂可与碘化钾水溶液发生反应生成氧气和单质碘。向反应后的溶液中滴入酚酞,溶液变为红色。
(1)试写出该反应的化学方程式(Ⅰ):_____。
(2)该反应体系中还伴随着化学反应(Ⅱ):I2(aq) + I-(aq)![]() I3-(aq)。反应Ⅱ的平衡常数表达式为:____。
I3-(aq)。反应Ⅱ的平衡常数表达式为:____。
(3)根据如图,计算反应Ⅱ中3-18s内用I2表示的反应速率为_____。

(4)为探究Fe2+对上述O3氧化I-反应的影响,将O3通入含Fe2+和I-的混合溶液中。试预测因Fe2+的存在可能引发的化学反应(请用文字描述,如:“碘离子被臭氧氧化为碘单质”)① ______。② _____;该反应的过程能显著降低溶液的pH,并提高反应(Ⅰ)中Ⅰ-的转化率,原因是:____ 。
(5)利用I2的氧化性可测定钢铁中硫的含量。做法是将钢铁中的硫转化为H2SO3,然后以淀粉为指示剂,用一定浓度的I2溶液进行滴定。综合上述各步反应及已有知识,可推知氧化性强弱关系正确的是____(填序号)。
a. Fe3+> I2 b. O3> Fe3+ c. I2> O2 d. I2>SO42-
查看答案和解析>>
科目: 来源: 题型:
【题目】海带中含有丰富的碘,为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
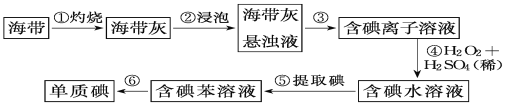
请填写下列空白:
(1)步骤①中灼烧海带时,除需要三脚架外,还需要用到的实验仪器是___;___;___;___。
(2)步骤③的实验操作名称是__;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是__。
(3)步骤④反应的离子方程式是___。
(4)步骤⑤中,某同学选择用苯来提取碘的理由是___。
(5)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法:___。
查看答案和解析>>
科目: 来源: 题型:
【题目】电解是一种非常强有力的促进氧化还原反应的手段,许多很难进行的氧化还原反应,都可以通过电解来实现。
(1)工业上常以石墨做电极,电解NaCl水溶液时,阴极区产物有____,其溶液可用于吸收工业尾气中的SO2,写出反应的化学方程式_____。
(2)电解NaCl水溶液时,用盐酸控制阳极区溶液的pH在2~3,用平衡移动原理解释盐酸的作用_____。离子液体是一种室温熔融盐,为非水体系。由有机阳离子、Al2Cl7-和AlCl4-组成的离子液体作电解液时,可在钢制品上发生电镀,有铝产生。
(3)铝原子的核外电子排布式是____,其中有____种不同能级的电子。
(4)为测定镀层厚度,用NaOH溶液溶解钢制品表面的铝镀层,当所得还原产物为6g时,转移电子的物质的量为___mol。
(5)用铝粉和Fe2O3做铝热反应实验,需要的试剂还有____(填编号)。
a.KClO3 b.Mg c.MnO2 d.KCl
取少量铝热反应所得的固体混合物,将其溶于足量稀H2SO4,滴加KSCN溶液无明显现象,不能说明固体混合物中无Fe2O3,理由是________(用离子方程式说明)。
查看答案和解析>>
科目: 来源: 题型:
【题目】在100g浓度为ω%的稀硫酸中加入4g氧化铜粉末,待氧化铜全部溶解后,向所得蓝色溶液中加入10g铁粉,充分反应后,过滤,得滤液和4.8g滤渣.下列计算结果正确的是
A.4.8g滤渣是由3.2g铜和1.6g铁组成B.ω=14.7
C.反应过程中产生的氢气是2.24LD.滤液是20.88%的硫酸亚铁溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com