
科目: 来源: 题型:
【题目】下图分别为生物体内分子的部分结构模式图,请据图回答问题:

(1)甲图中的三种物质分别属于动物、植物细胞中的储能物质的是_____,组成这三种物质的单体都是_____。
(2)乙图所示化合物的基本组成单位是___________,即图中字母_______________ 所示的结构表示,各基本单位之间是通过_____________(填“①”“②”或“③”)连接起来 的。
(3)丙图是由________个氨基酸经__________ 过程形成的,氨基酸的结构通式为__________ 。检验丙和戊可以用______________ 试剂。
(4)丁和戊中的 Mg2+、Fe2+体现了无机盐具有什么功能?_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下列实验操作和现象所得到的结论正确的是
选项 | 实验操作和现象 | 实验结论 |
A |
| 装置气密性良好 |
B | 将氧化铁加入到足量的HI溶液中,充分溶解后,滴加四氯化碳,震荡静置,下层呈紫红色。 | I2氧化性强与Fe3+ |
C | 往氢氧化铜沉淀中分别滴加盐酸和氨水,沉淀皆溶解 | 氢氧化铜为两性氢氧化物 |
D | 将SO2通入Na2CO3溶液中生成的气体,通入澄清石灰水中有浑浊 | 说明酸性:H2SO3﹥H2CO3 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】明矾[KAl(SO4)212H2O]在生产、生活中有广泛用途:饮用水的净化;造纸工业上作施胶剂;食品工业的发酵剂等。利用炼铝厂的废料 — 铝灰(含 Al、Al2O3 及少量 SiO2 和 FeOxFe2O3)可制备明矾。工艺流程如下:

回答下列问题:
(1)欲配制 480 ml 1.0 mol / L H2SO4 溶液,需要 18 mol / L H2SO4 溶液的体积是 _______,已有下列仪器:烧杯,量筒,胶头滴管,玻璃棒,还需用到的仪器是 _____________。
(2)“酸浸”过程中“,酸浸铁”发生反应的离子方程式是 ______________。
(3)明矾净水的原理是 _____________(用离子方程式表示)。
(4)检验滤液 A 中是否存在 Fe2+ 的实验操作是 __________________。
(5)在滤液 A 中加入高锰酸钾溶液的目的是 ________________(用离子方程式表示)(该条件下 MnO4- 转化为 Mn2+)
(6)已知:加入 MnSO4,Mn2+ 可与 MnO4- 反应生成 MnO2,该反应氧化剂与还原剂的物质的量之比为 ____________。
(7)操作Ⅱ是 ___________、__________、过滤、洗涤、干燥。
查看答案和解析>>
科目: 来源: 题型:
【题目】叶酸可以由下列甲、乙、丙三种物质合成。
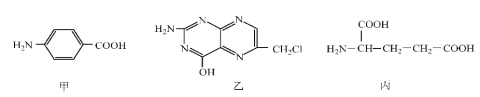
(1)甲的最简式为_____;丙中含有官能团的名称为____。
(2)下列关于乙的说法正确的是______(填序号)。
a.分子中碳原子与氮原子的个数比是7:5 b.属于芳香族化合物
c.既能与盐酸又能与氢氧化钠溶液反应 d.属于苯酚的同系物
(3)甲在一定条件下能单独聚合成高分子化合物,请写出该反应的化学方程式:____。
(4)甲可以通过下列路线合成(分离方法和其他产物已经略去):
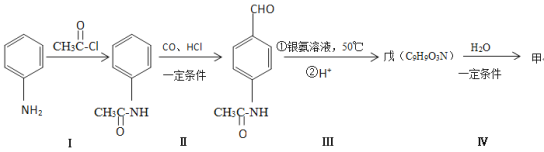
①步骤Ⅰ的反应类型是_______。
②步骤I和IV在合成甲过程中的目的是______。
③步骤IV反应的化学方程式为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】图为一常见的坐标曲线图。该图能够表示的生物学含义是

A. 人红细胞中K+吸收量随O2浓度变化的情况
B. 细胞代谢中反应速率随底物浓度变化的情况
C. 某植物光合作用速率随光照强度变化的情况
D. 萌发的种子中自由水含量随时间变化的情况
查看答案和解析>>
科目: 来源: 题型:
【题目】以A(C2H2)为原料合成食用香料E和吡咯(pyrrole)的路线如图所示,部分反应条件及产物略去。其中D在一定条件下可被氧化成酮。
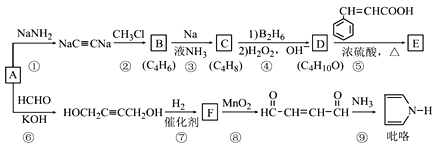
回答下列问题:
(1)A的名称是______;F中含氧官能团的名称是________________。
(2)⑥的反应类型是_____________,⑧的反应类型是_________________。
(3)反应⑤的化学方程式为____________________。
(4)已知C是反式产物,则C的结构简式为_______________。
(5)肉桂酸(![]() )的同分异构体中,含有苯环和碳碳双键,且能够发生水解反应的共有________种(不考虑顺反异构)。与D互为同分异构体,且核磁共振氢谱有面积比为2∶3的两组峰的有机物的结构简式是_________。
)的同分异构体中,含有苯环和碳碳双键,且能够发生水解反应的共有________种(不考虑顺反异构)。与D互为同分异构体,且核磁共振氢谱有面积比为2∶3的两组峰的有机物的结构简式是_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】硫化钠是用于皮革鞣制的重要化学试剂,可用无水芒硝(Na2SO4)与炭粉在高温下反应而制得,反应方程式如下:Na2SO4+4C →Na2S+ 4CO,Na2SO4+4CO→Na2S+4CO2
(1)现有无水芒硝17.75g,若生成过程中无水芒硝的利用率为80%,则理论上可得到Na2S_____g,最多生成标况下的CO_____L。
(2)若在反应过程中生成的Na2S3mol,则消耗的碳单质的物质的量 n的范围是____mol≤n≤___mol,若生成等物质的量CO和CO2,则消耗的碳的物质的量为____mol。
(3)Na2S放置在空气中,会被缓慢氧化成Na2SO4及 Na2SO3,现称取已经部分氧化的硫化钠样品78.40g溶于水中,加入足量盐酸,充分反应后过滤得沉淀19.20g,放出H2S气体2.24L(标准状况)。请计算:78.40g样品中各氧化产物的物质的量(写出必要的计算过程)。_____
查看答案和解析>>
科目: 来源: 题型:
【题目】W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,且四种元素的原子最外层电子数之和为24。下列说法错误的是
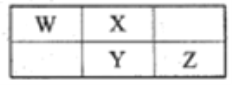
A. 单核阴离子的还原性Y强于X
B. W的气态氢化物与其最高价含氧酸反应生成离子化合物
C. X、Y、Z最简单氢化物中稳定性最弱的是Y
D. 在元素周期表中118号元素与Z位于同一主族
查看答案和解析>>
科目: 来源: 题型:
【题目】在一绝热(不与外界发生热交换)的恒容容器中,发生反应:2A(g)+B(s) ![]() C(g)+D(g),下列描述中能表明反应已达到平衡状态的有( )个
C(g)+D(g),下列描述中能表明反应已达到平衡状态的有( )个
①容器内温度不变 ②混合气体的密度不变 ③混合气体的压强不变
④混合气体的平均相对分子质量不变 ⑤C(g)的物质的量浓度不变
⑥容器内A、C、D三种气体的浓度之比为2:1:1 ⑦某时刻v(A)=2v(C)且不等于零
⑧单位时间内生成n mol D,同时生成2n mol A
A. 4 B. 5 C. 6 D. 7
查看答案和解析>>
科目: 来源: 题型:
【题目】下述实验中均有红棕色气体产生,对比分析所得结论不正确的是( )
|
|
|
① | ② | ③ |
A.由①中的红棕色气体,推断产生的气体一定是混合气体
B.红棕色气体不能表明②中木炭与浓硝酸发生了反应
C.由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D.③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com