
科目: 来源: 题型:
【题目】恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图1所示。
已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196.6 kJ/mol。
2SO3(g) ΔH=-196.6 kJ/mol。

请回答下列问题:
(1)写出能表示硫的燃烧热的热化学方程式: 。
(2)状态II到状态III放出的热量为 。
(3)恒温恒容时,1 mol SO2和2 mol O2充分反应,放出热量的数值比∣ΔH2∣ (填“大”、“小”或“相等”)。
(4)将Ⅲ中的混合气体通入足量的NaOH溶液中消耗NaOH的物质的量为 ,若溶液中发生了氧化还原反应,则该过程的离子方程式为: 。
(5)恒容条件下,下列措施中能使n(SO3)/ n(SO2)增大的有 。
A.升高温度
B.充入He气
C.再充入1 mol SO2(g)和1 mol O2(g)
D.使用催化剂
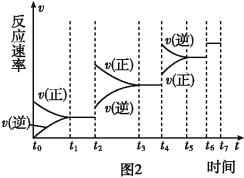
(6)某SO2(g)和O2 (g)体系,时间t1达到平衡后,改变某一外界条件,反应速率v与时间t的关系如图2所示,若不改变SO2(g)和O2(g)的量,则图中t4时引起平衡移动的条件可能是 ;图中表示平衡混合物中SO3的含量最高的一段时间是 。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上可利用“甲烷蒸气转化法”生产氢气,反应的热化学方程式为CH4(g)+H2O(g)CO2(g)+3H2(g) △H=+161.1kJ·mol-1
(1)已知温度、压强对甲烷平衡时的体积分数的影响如图1,请回答:

①图1中a、b、c、d四条曲线中的两条代表压强分别为1MPa、2MPa时甲烷体积分数的曲线,其中表示1MPa的是_____。
②该反应的平衡常数:K(600℃)___(填“>”“<”或“=”)K(700℃)。
(2)①已知:在700℃、1MPa时,1molCH4与1molH2O在1L的密闭容器中反应,6min时达到平衡(如图2),此时CH4的转化率为__,该温度下反应的平衡常数为____(结果保留小数点后一位数字)。
②从图2分析,由第一次平衡到第二次平衡,平衡移动的方向是____(填“向正反应方向”或“向逆反应方向”)移动,采取的措施可能是____。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学反应2A![]() B+D在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
实验 序号 | 时间 浓度 温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
2 | 800℃ | C2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
3 | 800℃ | C3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
根据上述数据,完成下列填空:
(1)在实验1中,反应在10至20分钟内A的平均速率为____________。
(2)在实验2中,A的初始浓度=_____,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是____。
(3)设实验3中的反应速率为v3,实验1的反应速率为v1,则v3______v1(填“>”、“=”或“<”),且C3___1.0mol/L(填“<”、“=”或“>”)。
(4)比较实验4和实验1,可推测该反应是____反应(填“吸热”或“放热”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】将水分解制得氢气的一种工业方法是“硫﹣碘循环法”,依次涉及下列三步反应:
I.SO2+2H2O+I2=H2SO4+2HI
II.2HI(g)H2(g)+I2(g)
III.2H2SO4=2SO2+O2+2H2O
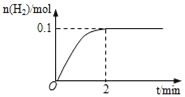
(1)一定温度下,向5L恒容密闭容器中加入1molHI,发生反应II,H2物质的量随时间的变化如图所示。0~2min内的平均反应速率v(HI)=___。相同温度下,若起始加入的HI改为2mol,反应达平衡时H2的量为___mol。
(2)分析上述反应,下列判断错误的是___(填写选项编号,只有一个正确选项)。
a.三步反应均为氧化还原反应
b.循环过程中产生1molH2,同时产生1molO2
c.在整个分解水的过程中SO2和I2相当于催化剂
查看答案和解析>>
科目: 来源: 题型:
【题目】1.28g铜投入一定量浓HNO3中,铜完全溶解,生成气体颜色越来越浅,共收集到672mL气体(标况)。将盛有此气体的容器倒扣在水中,通入标况下一定体积的O2,恰好使气体完全溶于水中,则通入O2的体积是
A.224mLB.168mLC.336mLD.448mL
查看答案和解析>>
科目: 来源: 题型:
【题目】通过对实验现象的观察、分析推理得出正确的结论是化学学习的方法之一.对下列实验事实的解释不正确的是
现象 | 解释或结论 | |
A | SO2使酸性高锰酸钾溶液褪色 | SO2表现还原性 |
B | 铝片放入浓硫酸中,无明显变化 | 说明铝与冷的浓硫酸不发生化学反应 |
C | 某溶液中加入浓NaOH溶液加热,放出气体能使湿润的红色石蕊试纸变蓝 | 该溶液中一定含有NH |
D | 浓HNO3在光照条件下变黄 | 浓HNO3不稳定,生成有色产物能溶于浓硝酸 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关SO2的性质的探究实验报告记录的实验现象正确的是
实验 |
| ||||
记录 | A | 无色 | 无色 | 无色溶液 | 无色溶液 |
B | 红色 | 无色 | 白色沉淀 | 白色沉淀 | |
C | 红色 | 无色 | 白色沉淀 | 无色溶液 | |
D | 无色 | 无色 | 无色溶液 | 无色溶液 | |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,在一容积不变的密闭容器中发生的可逆反应2X(g)![]() Y(g)+Z(g),达到反应限度的标志是
Y(g)+Z(g),达到反应限度的标志是
A.反应容器中压强不再变化B.反应容器中密度不再变化
C.X、Y、Z的浓度之比为2:1:1D.单位时间内生成1molY的同时生成2molX
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下在体积为5L的密闭容器中发生某可逆反应,其化学平衡常数表达式为:K=![]() 。
。
(1)请写出该反应的化学方程式:___。
(2)恒温恒容条件下容器中气体的平均相对分子质量、气体的分子总数或混合气体的___不再随时间变化,都可说明该反应已达平衡状态。
(3)该反应的逆反应速率随时间变化的关系如图,t1时的突变一定是因为某种条件的改变,该改变不可能是___;
a.减小H2浓度 b.使用催化剂 c.升高温度

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com