
科目: 来源: 题型:
【题目】(1)写出氯碱工业电解饱和食盐水的化学方程式:_______________
(2)已知:2KMnO4 + 16HCl =2KCl+2MnCl2 +5Cl2↑+8H2O,15.8g KMnO4 与 100mL12mol/L浓盐酸充分反应,固体完全溶解,生成标准状况下氯气的体积为______L,转移的电子数____个,若向反应后的溶液中加入足量的硝酸银,过滤、洗涤、干燥,可得到固体 _____mol。
(3)将标准状况下 6.72L 的 HCl 溶于水形成 250mL 溶液,取出 10mL 于锥形瓶中,溶质的物质的量浓度为_________mol/L,向锥形瓶中滴加 0.5mol/LBa(OH)2 溶液,恰好反应,消耗Ba(OH)2 的体积为______mL。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)0.3 mol NH3分子中所含原子数与________个H2O分子中所含原子数相等。
(2)0.1 mol/L Al2(SO4)3溶液100mL与0.3mol/LK2SO4溶液200mL混合,则所得溶液中硫酸根离子的物质的量浓度为__________。(混合后,忽略体积变化)
(3)相同质量的SO2、SO3的氧原子的个数之比为____,体积比_______。
(4)液态化合物在一定量的氧气中恰好完全燃烧,反应方程式为:XY2(l)+3O2(g)=XO2(g)+2YO2(g)冷却后,在标准状况下测得生成物的体积是336mL,密度是2.56g/L.
①反应前O2的体积是_____mL(标准状况),化合物XY2的摩尔质量是_____.
②若XY2分子中X、Y两元素的质量比是3:16,则X、Y两元素分别为_____和_____(写元素符号).
查看答案和解析>>
科目: 来源: 题型:
【题目】金属钛性能优越,被誉为继 Fe、Al 后应用广泛的“第三金属”。
(1)Ti 基态原子的价层电子排布图为_____。
(2)钛能与 B、C、N、O 等非金属元素形成稳定的化合物。电负性C_____(填“>”或“<”,下同) B;第一电离能:N_O,原因是_________。
(3)月球岩石——玄武岩的主要成分为钛酸亚铁(FeTiO3)。FeTiO3 与 80%的硫酸反应可生成TiOSO4。SO42-的空间构型为_____形,其中硫原子采用______杂化,写出 SO42- 的一种等电子体的化学式________。
(4)Ti 的氧化物和 CaO 相互作用能形成钛酸盐 CaTiO3,CaTiO3 的晶体结构如图 1 所示,(Ti4+位于立方体的顶点)。该晶体中,Ti4+和周围 _______个 O2-相紧邻。

(5)铁晶胞的结构如图 2 所示,如果晶胞边长为 a,铁原子半径为 r,则该晶体中铁原子的空间利用率为______。(只含Π的代数式)
查看答案和解析>>
科目: 来源: 题型:
【题目】某兴趣小组设计了如图所示的实验装置,既可用于制取气体,又可用于验证物质的性质。
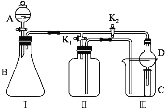
(1)打开K1关闭K2,可制取某些气体。甲同学认为装置Ⅰ可用于制取H2、NH3、O2,但装置Ⅱ只能收集H2、NH3,不能收集O2。其理由是_____。乙同学认为在不改动装置Ⅱ仪器的前提下,对装置Ⅱ进行适当改进,也可收集O2。你认为他的改进方法是_____。
(2)打开K2关闭K1,能比较一些物质的性质。丙同学设计实验比较氧化性:KClO3>Cl2>Br2。在A中加浓盐酸后一段时间,观察到C中的现象是______;仪器D在该装置中的作用是_______。在B装置中发生反应的离子方程式为______。丁同学用石灰石、醋酸、苯酚钠等药品设计了另一实验。他的实验目的是_____。
(3)实验室常用浓H2SO4与硝酸钠反应制取HNO3。下列装置中最适合制取HNO3的是_____。实验室里贮存浓硝酸的方法是_______。
a 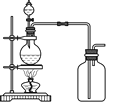 b
b 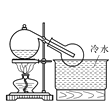 c
c 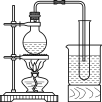 d
d 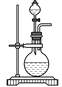
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应中,生成物所储存的化学能比反应物所储存的化学能多的是
A.2Na2O2 + 2H2O = 4NaOH + O2↑
B.NaOH + HCl = NaCl + H2O
C.CH4 + 2O2 ![]() CO2 + 2H2O
CO2 + 2H2O
D.Ba(OH)2·8H2O + 2NH4Cl = BaCl2 + 2NH3↑ + 10H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】某原电池装置如图所示,电池总反应为 2Ag + Cl2 = 2AgCl。已知阳离子交换膜只允许阳离子通过,阴离子不能通过,离子交换过程中溶液电荷守恒。下列说法正确的是

A.正极反应式为 AgCl + e—= Ag + Cl—
B.放电时,交换膜右侧溶液中有大量白色沉淀生成
C.若用 NaCl 溶液代替盐酸,则电池总反应随之改变
D.当外电路中转移 0.1mol e—时,阳离子交换膜左侧溶液中约减少0.2mol 离子
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度范围内用氯化钠熔浸钾长石(主要成份为KAlSi3O8)可制得氯化钾,主要反应是:NaCl(l)+KAlSi3O8(s) ![]() KCl(l)+NaAlSi3O8(s),完成下列填空:
KCl(l)+NaAlSi3O8(s),完成下列填空:
(1)上述反应涉及的第三周期元素中,离子半径最小的是___;Cl原子与Si原子可构成有5个原子核的分子,其分子的空间构型为____。
(2)用最详尽描述核外电子运动状态的方式,表示氧离子核外电子的运动状态_____。
(3)Na和O2反应形成Na2O和Na2O2的混合物,阴阳离子的个数比为__;NaAlSi3O8改写成氧化物形式是___。
(4)某兴趣小组为研究上述反应中钾元素的熔出率(液体中钾元素的质量占样品质量分数)与温度的关系,进行实验(保持其它条件不变),获得如下数据:
1.5 | 2.5 | 3.0 | 3.5 | 4.0 | |
800℃ | 0.054 | 0.091 | 0.127 | 0.149 | 0.165 |
830℃ | 0.481 | 0.575 | 0.626 | 0.669 | 0.685 |
860℃ | 0.515 | 0.624 | 0.671 | 0.690 | 0.689 |
950℃ | 0.669 | 0.711 | 0.713 | 0.714 | 0.714 |
分析数据可以得出,氯化钠熔浸钾长石是__________反应(填“放热”或“吸热”);在950℃时,欲提高熔出钾的速率可以采取的一种措施是_______。
(5)Na(l)+KCl(l) ![]() NaCl(l)+K(g)是工业上冶炼金属钾常用的方法,该方法可行的原因是___。
NaCl(l)+K(g)是工业上冶炼金属钾常用的方法,该方法可行的原因是___。
(6)铝可用于冶炼难熔金属,利用铝的亲氧性,还可用于制取耐高温的金属陶瓷。例如将铝粉、石墨和二氧化钛按一定比例混合均匀,涂在金属表面上,然后在高温下煅烧,可在金属表面形成耐高温的涂层TiC,该反应的化学方程式为_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】硝酸与金属反应时,浓度越稀还原产物价态越低。现用一定量的铝粉与镁粉组成的混合物与100mL硝酸钾溶液与硫酸组成的混合溶液充分反应,反应过程中无任何气体放出,向反应后的溶液中逐滴加入4.00mol/L的NaOH溶液,加入的溶液体积与产生的沉淀质量的关系如图所示。

下列结论正确的是
A.铝与混合溶液反应的离子方程式为8Al+3OH-+3NO3-→8Al3++3NH4++9H2O
B.参加反应硝酸根离子物质的量为0.06 mol
C.参加反应的铝与镁的质量之比为4︰3
D.混合液中硫酸的物质的量的浓度为0.36 mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】铬及其化合物在工农业生产中具有广泛应用,请回答下列问题:
(1)基态铬原子的核外电子排布式为_____________。
(2)Cr3+能形成配离子[Cr(H2O)(H2NCH2CH2NH2)]3+,在配体H2NCH2CH2NH2 中采用 sp3杂化的原子有_____。
(3)氯化铬酰(CrO2Cl2)熔点:-96.5℃,沸点:117℃,能与 CS2 等互溶.则固态 CrO2Cl2属于________晶体。已知 NO2+与 CS2 互为等电子体,则 1molNO2+中含有π键数目为 ____________
(4)Cr2O3 晶胞结构如图所示,已知 Cr2O3 的摩尔质量为 M g/mol,晶体的密度为ρ g·cm-3 ,晶胞体积为 V cm3. 晶胞结构示意图中的小黑球代表_____(填“铬离子”或“氧离子”),阿伏加德罗常数NA=_________mol-1(用含 M, V, ρ的代数式表示 )。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com