
科目: 来源: 题型:
【题目】聚硅酸铁是目前无机高分子絮凝剂研究的热点,一种用钢管厂的废铁渣(主要成分Fe3O4,少量碳及二氧化硅)为原料制备的流程如下:
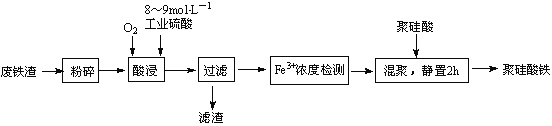
(1)废铁渣进行“粉碎”的目的是____________。
(2)“酸浸”需适宜的酸浓度、液固比、酸浸温度、氧流量等,其中酸浸温度对铁浸取率的影响如右图所示:
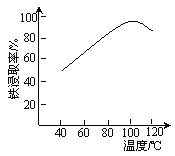
①加热条件下酸浸时,Fe3O4与硫酸反应的化学方程式为___________。
②酸浸时,通入O2的目的是_____________,该反应的离子方程式为_________。
③当酸浸温度超过100℃时,铁浸取率反而减小,其原因是____________。
(3)滤渣的主要成分为____________(填化学式)。
(4)“Fe3+浓度检测”是先用SnCl2将Fe3+还原为Fe2+;在酸性条件下,再用K2Cr2O7标准溶液滴定Fe2+(Cr2O72-被还原为Cr3+),该滴定反应的离子方程式为______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】铀是原子反应堆的原料,常见铀的化合物有UF4、UO2及(NH4)4[UO2(CO3)3]等。回答下列问题:
(1)UF4用Mg或Ca还原可得金属铀。与钙同周期基态原子的未成对电子数为2的元素共有___种;原子序数为镁元素的二倍的元素的基态原子价电子排布图为_______。
(2)已知:2UO2+5NH4HF2 150℃ 2UF4·NH4F+3NH3↑+4H2O↑ HF2-的结构为[F-H…F]-
①NH4HF2中含有的化学键有__________ (填选项字母)。
A.氢键 B.配位键 C.共价键 D.离子键 E.金属键
②与氧同周期,且第一电离能比氧大的元素有______种。
(3)已知:3(NH4)4[UO2(CO3)3] 800℃ 3UO2+10NH3↑+9CO2↑+N2↑+9H2O↑
①物质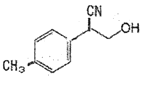 中与CO32-的碳原子杂化类型相同和不同的碳原子的个数比为______。
中与CO32-的碳原子杂化类型相同和不同的碳原子的个数比为______。
②分解所得的气态化合物的分子键角由小到大的顺序为_________(填化学式)
(4)下列排列方式中,通常条件下Cu的晶体的堆积方式是_________(填序号)。
A.ABCABCABC B.ABABABABAB C.ABBAABBA D.ABCCBCABCCBA
(5)水在不同的温度和压力条件下可形成11种不同结构的晶体,密度从比水轻的0.92g/cm3到约为水的1.5倍。冰是人们迄今已知的由一种简单分子堆积出结构花样最多的化合物。其中冰- Ⅶ的晶体结构为一个如图所示的立方晶胞,每个水分子与周围4个水分子以氢键结合。设O-H-O距离为apm,阿伏加德罗常数的值为NA,则该冰Ⅶ晶体的密度为____ g/cm3(列出计算式即可)。
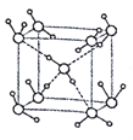
查看答案和解析>>
科目: 来源: 题型:
【题目】含氮化合物对环境、生产和人类生命活动等具有很大的影响。请按要求回答下列问题
(1)利用某分子筛作催化剂,NH3可脱除工厂废气中的NO、NO2,反应机理如下图所示。A包含物质为H2O和___________(填化学式)
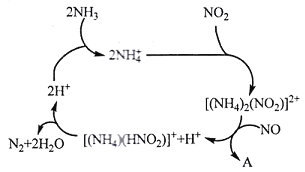
(2)已知:4NH3(g)+6NO(g) =5N2(g)+6H2O(g) △H1=-a kJ/mol
4NH3(g)+5O2(g)= 4NO(g)+6H2O(g) △H2=-b kJ/mol
H2O(l)=H2O(g) △H3=+c kJ/mol
则反应4NH3(g)+3O2(g)=2N2(g)+6H2O(l)的△H=___________ kJ/mol
(3)工业上利用氨气生产氢氰酸(HCN的反应为:CH4(g)+NH3(g)![]() HCN(g)+3H2(g ) △H>0
HCN(g)+3H2(g ) △H>0
①其他条件一定,达到平衡时NH3转化率随外界条件X变化的关系如图甲所示。则X可以是___________(填字母序号)
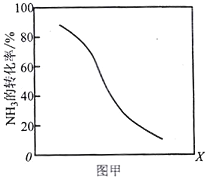
a.温度 b.压强 c.催化剂 d.![]()
②在一定温度下,向2L密闭容器中加入 n mol CH4和2 moI NH3,平衡时NH3体积分数随n变化的关系如图乙所示。
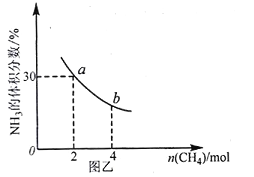
a点时,CH4的转化率为___________%;平衡常数:K(a)_____K(b)(填“>”“=”或“<”)。
(4)肌肉中的肌红蛋白(Mb)与O2结合生成MbO2,其反应原理可表示为: Mb(ag)+O2(g)![]() MbO2(aq),该反应的平衡常数可表示为:
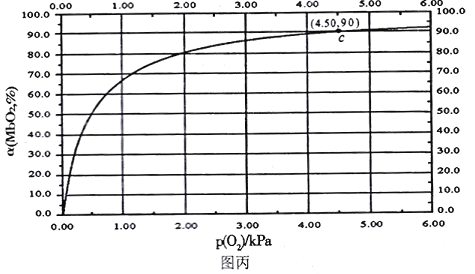
MbO2(aq),该反应的平衡常数可表示为:![]() 。在37℃条件下达到平衡时,测得肌红蛋白的结合度(a)与P(O2)的关系如图丙所示[
。在37℃条件下达到平衡时,测得肌红蛋白的结合度(a)与P(O2)的关系如图丙所示[![]() ]。研究表明正反应速率ν正=k正·c(Mb) · P(O2),逆反应速率ν逆=k逆·c(MbO2)(其中k正和k逆分别表示正反应和逆反应的速率常数)。
]。研究表明正反应速率ν正=k正·c(Mb) · P(O2),逆反应速率ν逆=k逆·c(MbO2)(其中k正和k逆分别表示正反应和逆反应的速率常数)。
①试写出平衡常数K与速率常数k正、k逆之间的关系式为K=___________(用含有k正、k逆的式子表示)。
②试求出图丙中c点时,上述反应的平衡常数K=___________kPa-1。已知k逆=60s-1,则速率常数k正=___________s-1·kPa-1。
查看答案和解析>>
科目: 来源: 题型:
【题目】25 ℃时,NaCN溶液中CN-、HCN浓度所占分数(δ)随pH变化的关系如下图甲所示。向10 mL 0.01 mol·L-1 NaCN溶液中逐滴加入0.01 mol·L-1的盐酸,其pH变化曲线如下图乙所示。
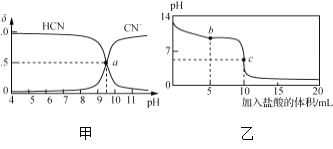
下列溶液中微粒的物质的量浓度关系一定正确的是( )
A. 图甲中pH=7的溶液:c(Cl-)=c(HCN)
B. 图甲中a点的溶液:c(CN-)<c(Cl-)
C. 图乙中b点的溶液:c(CN-)>c(Cl-)>c(HCN)>c(OH-)>c(H+)
D. 图乙中c点的溶液:c(Na+)+c(H+)=c(HCN)+c(OH-)+2c(CN-)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式表达正确的是( )
A.向硫酸铁溶液中加入过量铁粉:Fe+2Fe3+=3Fe2+
B.向Na2CO3溶液中滴加稀盐酸:Na2CO3+2H+=2Na++CO2↑+H2O
C.向铜粉中加入稀硫酸:Cu+2H+=Cu2++H2↑
D.向铝粉中加入足量NaOH溶液:2Al+2OH-=2AlO![]() +H2↑
+H2↑
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上氟气可作为火箭燃料中的氧化剂,氟单质的制备通常采用电解法。已知:KF+HF===KHF2,电解熔融的氟氢化钾(KHF2)和无水氟化氢的混合物制备F2的装置如图所示。下列说法错误的是
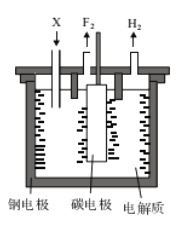
A. 钢电极与电源的负极相连
B. 电解过程中需不断补充的X是KF
C. 阴极室与阳极室必须隔开
D. 氟氢化钾在氟化氢中可以电离
查看答案和解析>>
科目: 来源: 题型:
【题目】Li是最轻的固体金属,采用Li作为负极材料的电池具有小而轻、能量密度大等优良性能,得到广泛应用。回答下列问题:
(1)下列Li原子电子排布图表示的状态中,是基态原子电子排布图的是________(填标号),能量(由低到高)排在第二位的是__________(填标号)。
A.![]()
B.![]()
C.![]()
D.![]()
(2)Li+与H-具有相同的电子构型,r(H-)______r(Li+)(填“<”或“>”),LiAlH4中,不存在_________(填标号)。
A.离子键 B.σ键 C.π键 D.氢键
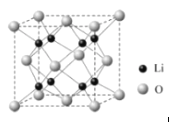
(3)Li2O是离子晶体,其晶格能可通过图(a)的Bormi﹣Haber循环计算得到。

可知,Li2O晶格能为________kJmol﹣1,Li原子的第一电离能为_______kJmol﹣1,O=O键键能为________kJmol﹣1。
(4)Li2O晶胞如图所示。1个晶胞中有Li+______个,O2-_______个。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,甲和乙均是双液原电池装置,下列说法不正确的是( )
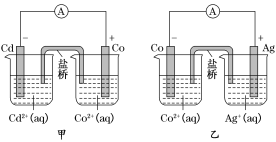
A. 甲中电池总反应的离子方程式为Cd(s)+Co2+(aq)=Co(s)+Cd2+(aq)
B. 盐桥的作用是形成闭合回路,并使两边溶液保持电中性
C. 反应2Ag(s)+Cd2+(aq)=Cd(s)+2Ag+(aq)能够发生
D. 乙电池中有1mol电子通过外电路时,正极有1mol Ag析出
查看答案和解析>>
科目: 来源: 题型:
【题目】在密闭容器中通入一定量的HI气体,使其在一定条件下发生反应:2HI(g)![]() H2(g)+I2(g),下列能够标志反应达到平衡状态的是( )
H2(g)+I2(g),下列能够标志反应达到平衡状态的是( )
A. HI、H2、I2的浓度相等
B. 混合气体的总压不变
C. 混合气体的颜色不变化
D. v(HI):v(H2):v(I2)=2:1:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com