
科目: 来源: 题型:
【题目】一种有机玻璃的结构简式为 。下列关于它的叙述中不正确的是( )
。下列关于它的叙述中不正确的是( )
A. ![]() 在一定条件下发生缩聚反应即可合成该有机玻璃
在一定条件下发生缩聚反应即可合成该有机玻璃
B. 该有机玻璃能发生氧化反应
C. 合成该有机玻璃的原料可能有甲烷
D. 它在一定条件下发生水解反应时C—O键断裂
查看答案和解析>>
科目: 来源: 题型:
【题目】在有机物分子中,不同氢原子的核磁共振氢谱中给出的峰值(信号)不同,根据峰值(信号)可以确定有机物分子中氢原子的种类和数目。如乙醚的结构简式为CH3—CH2—O—CH2—CH3,其核磁共振氢谱中给出的峰值(信号)有两种。化合物A和B的分子式都是C2H4Br2,A的核磁共振氢谱如图所示,则A的结构简式为________________,请预测B的核磁共振氢谱上有________种峰值(信号)。

查看答案和解析>>
科目: 来源: 题型:
【题目】Li是最轻的固体金属,采用Li作为负极材料的电池具有小而轻、能量密度大等优良性能,得到广泛应用。回答下列问题:
(1)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为_____、_____(填标号)。
A. B.
B.
C.![]() D.
D.![]()
(2)Li+与H具有相同的电子构型,r(Li+)小于r(H),原因是______。
(3)LiAlH4是有机合成中常用的还原剂,LiAlH4中的阴离子空间构型是______、中心原子的杂化形式为______。LiAlH4中,存在_____(填标号)。
A.离子键 B.σ键 C.π键 D.氢键
(4)Li2O是离子晶体,其晶格能可通过图(a)的BornHaber循环计算得到。
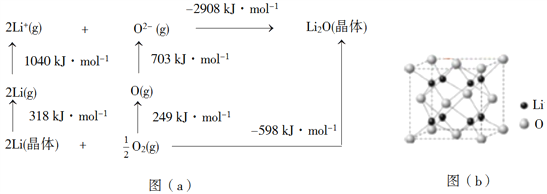
可知,Li原子的第一电离能为________kJ·mol1,O=O键键能为______kJ·mol1,Li2O晶格能为______kJ·mol1。
(5)Li2O具有反萤石结构,晶胞如图(b)所示。已知晶胞参数为0.4665 nm,阿伏加德罗常数的值为NA,则Li2O的密度为______g·cm3(列出计算式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】月桂烯(![]() )是重要的化工原料,广泛用于香料行业。
)是重要的化工原料,广泛用于香料行业。
(1)月桂烯与足量氢气完全加成后生成A,A的名称是_________________________;
(2)以月桂烯为原料制取乙酸香叶酯的流程如下图:

①B中官能团的名称______________________;
②乙酸香叶酯的化学式____________________;
③反应Ⅰ的反应类型是____________________;
④反应Ⅱ的化学方程式是__________________________________________________;
(3)已知:烯烃臭氧化还原水解反应生成羰基化合物,如:
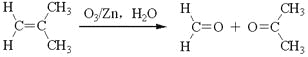
一定条件下,月桂烯可实现如下图所示转化(图中部分产物已略去):
![]()
①C与新制的Cu(OH)2悬浊液反应的化学方程式为:
_______________________________________________________________;
②E在一定条件下能发生缩聚反应,写出其产物的结构简式____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】关于化学能与其他能量相互转化的说法错误的是( )
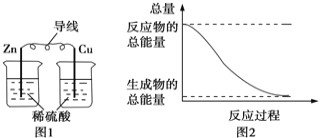
A.图1所示的装置能将化学能转变为电能
B.图2所示的反应为放热反应
C.中和反应中,生成物的总能量比反应物的总能量低
D.化学反应中能量变化的主要原因是化学键的断裂与形成
查看答案和解析>>
科目: 来源: 题型:
【题目】利用“价类二维图”研究物质的性质是化学研究的重要手段。如图是氯元素的化合价与部分物质类别的对应关系。

回答下列问题:
(1)X的电离方程式为_________。
(2)氯的某种氧化物(ClmOn)中氯、氧元素质量比为71:48,则m:n= _________。
(3) NaClO有较强的氧化性,所以是常用的消毒剂和漂白剂,请写出工业上用氯气和NaOH溶液生产消毒剂NaClO的离子方程式_____________。
(4)NaClO2具有很强的氧化性,常用作消毒剂,其消毒效率是Z的 ___________倍(还原产物都为Cl-,消毒效率以单位物质的量得到的电子数表示)。
(5)Cl2O可用潮湿的Z与Na2CO3反应制取,同时生成NaHCO3,反应中Z既体现氧化性,又体现还原性,该反应的化学方程式为_____________。
(6)自来水中的![]() 对人类健康产生危害。为了降低自来水中
对人类健康产生危害。为了降低自来水中![]() 的浓度,某研究人员提出在碱性条件下用Al粉还原
的浓度,某研究人员提出在碱性条件下用Al粉还原![]() ,产物是N2。发生的反应可表示如下,请完成方程式的配平:___Al+ ____
,产物是N2。发生的反应可表示如下,请完成方程式的配平:___Al+ ____![]() + _____=___
+ _____=___![]() + _____ N2↑ + _______H2O
+ _____ N2↑ + _______H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】向Cu和CuO的混合物中加入0.6 L 2.0 mol/L的稀硝酸,混合物完全溶解,同时生成标准状况下NO 4.48 L。向所得溶液中加入一定体积1.0 mol/L NaOH溶液,恰好使Cu2+完全沉淀,将沉淀洗涤,充分灼烧后得32.0 g固体。求:
(1)混合物中Cu的质量是____________。
(2)混合物消耗HNO3的物质的量是____________。
(3)NaOH溶液的体积是____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】核磁共振谱(NMR)是研究有机化合物结构的重要手段。在所研究的化合物分子中,等性氢原子在NMR谱中都给出了相应的峰(信号),谱中峰的强度与结构中氢原子数成正比。如乙醛分子(CH3CHO)的NMR谱中有2个峰,其强度比是3∶1。乙醇分子(CH3CH2OH)的NMR谱中有3个峰,其强度比是 3∶2∶1。
(1)苯的NMR谱中应该有________个峰;甲苯的NMR谱中有_______个峰。
(2)某化合物C3H6O2的NMR谱中有3个峰,其强度比为3∶2∶1,则该化合物的结构简式可能为______。
(3)研究发现,结构简式为CH3CH![]() CHCl的化合物的NMR谱中有6个峰,原因是_____。
CHCl的化合物的NMR谱中有6个峰,原因是_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】
化合物G是治疗高血压的药物“比索洛尔”的中间体,一种合成G的路线如下:
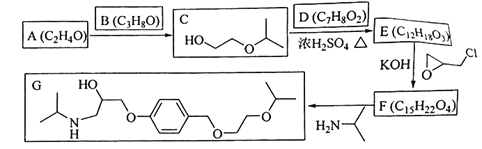
已知以下信息:
①A的核磁共振氢谱为单峰;B的核磁共振氢谱为三组峰,峰面积比为6∶1∶1。
②D的苯环上仅有两种不同化学环境的氢;1molD可与1mol NaOH或2mol Na反应。
回答下列问题:
(1)A的结构简式为____________。
(2)B的化学名称为____________。
(3)C与D反应生成E的化学方程式为____________。
(4)由E生成F的反应类型为____________。
(5)G是分子式为____________。
(6)L是D的同分异构体,可与FeCl3溶液发生显色反应,1mol的L可与2mol的Na2CO3反应,L共有______种;其中核磁共振氢谱为四组峰,峰面积比为3∶2∶2∶1的结构简式为___________、____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业常用燃料与水蒸气反应制备H2和CO,再用H2和CO合成甲醇。
(1)制取H2和CO通常采用:C(s)+H2O(g)CO(g)+H2(g)△H=+131.4kJmol-1,下列判断正确的是_______。
a.该反应的反应物总能量小于生成物总能量
b.标准状况下,上述反应生成1L H2气体时吸收131.4 kJ的热量
c.若CO(g)+H2(g)C(s)+H2O(1)△H=﹣QkJmol-1,则Q<131.4
d.若C(s)+CO2(g)2CO(g)△H1;CO(g)+H2O(g)H2(g)+CO2(g)△H2则:△H1+△H2=+131.4kJmol-1
(2)甲烷与水蒸气反应也可以生成H2和CO,该反应为:CH4(g)+H2O(g)CO(g)+3H2(g)。已知在某温度下2L的密闭绝热容器中充入2.00mol甲烷和1.00mol水蒸气,测得的数据如表:
不同时间各物质的物质的量/mol | ||||
0min | 2min | 4min | 6min | |
CH4 | 2.00 | 1.76 | 1.60 | n2 |
H2 | 0.00 | 0.72 | n1 | 1.20 |
根据表中数据计算:
①0min~2min 内H2的平均反应速率为_____________________。
②达平衡时,CH4的转化率为_____________;在上述平衡体系中再充入2.00mol甲烷1.00mol 水蒸气,达到新平衡时H2的体积分数与原平衡相比___________(填“变大”、“变小”或“不变”),可判断该反应达到新平衡状态的标志有__________(填字母)。
a.CO的含量保持不变 b.容器中c(CH4)与c(CO)相等
c.容器中混合气体的密度保持不变 d.3υ正(CH4)=υ逆(H2)
(3)合成甲醇工厂的酸性废水中含有甲醇(CH3OH),常用向废液中加入硫酸钴,再用微生物电池电解,电解时Co2+被氧化成Co3+,Co3+把水中的甲醇氧化成CO2,达到除去甲醇的目的。工作原理如图( c为隔膜,甲醇不能通过,其它离子和水可以自由通过):

①a电极的名称为__________。
②写出除去甲醇的离子方程式______________________。
③微生物电池是绿色酸性料电池,写出该电池正极的电极反应式为__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com