
科目: 来源: 题型:
【题目】硼镁泥是一种工业废料,主要成分是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO4·7H2O的流程如下:
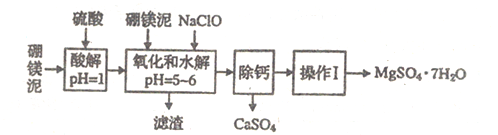
根据题意回答下列问题:
(1)实验中需用1mo/L的硫酸800mL,若用18.4mol/L的浓硫酸来配制,量取浓硫酸时,需使用的量筒的规格为____________
A.10mL B.20mL C.50mL D.100mL
(2)加入的NaClO可与Mn2+反应:Mn2++ClO-+H2O=MnO2↓+2H++Cl-,还有一种离子也会被NaClO氧化,该反应的离子方程式为_________________。
(3)滤渣的主要成分中除含有Fe(OH)3、Al(OH)3外还有________________。
(4)在“除钙”前,需检验滤波中Fe3+是否被除尽,简述检验方法:______________。
(5)已知MgSO4、CaSO4的溶解度如下表:
温度/℃ | 40 | 50 | 60 | 70 |
MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤: “操作Ⅰ”是将滤液继续蒸发浓缩,冷却结晶,__________,便得到了MgSO4·7H2O。
(6)实验中提供的硼镁泥共10g,得到的MgSO4·7H2O为17.22g,则MgSO4·7H2O的产率为__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某实验小组对菠菜中的铁元素(主要以难溶的FeC2O4形式存在)进行检测。实验如下:
I.水煮检验法:
II灼烧检验法: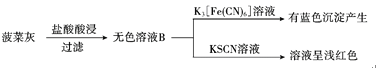
(1)CCl4的作用为______。
(2)操作i中起分离作用的仪器名称为______。
(3)溶液A中未能检测出Fe2+的可能原因是______。
(4)取无色溶液B,先滴加H2O2溶液,再滴加KSCN溶液,溶液呈红色。用离子方程式表示H2O2的作用:______。
(5)甲同学取少量无色溶液B,滴加酸性KMnO4溶液,振荡后,溶液紫色消失,因此得出结论,溶液B含有Fe2+。乙同学认为甲同学的实验方法不严谨,设计并完成如下实验:用稀硝酸溶解菠菜灰,产生的无色气体使澄清石灰水变浑浊,得到的无色溶液中滴加AgNO3溶液,产生白色沉淀(Ag2C2O4)。甲同学反思自己的方法不严谨,理由是_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.CO2是重要的化工原料,也是应用广泛的化工产品。CO2与过氧化钠或超氧化钾反应可产生氧气。完成下列计算:
(1)CO2通入氨水生成NH4HCO3,NH4HCO3很容易分解。2.00mol NH4HCO3完全分解,分解产物经干燥后的体积为_________L(标准状况)。
(2)某H2中含有2.40 molCO2,该混合气体通入2.00 L NaOH溶液中,CO2被完全吸收。如果NaOH完全反应,该NaOH溶液的浓度为_______。
(3)CO2和KO2有下列反应:
4KO2+2CO2→2K2CO3+3O2 4KO2+4CO2+2H2O→4KHCO3+3O2
若9 mol CO2在密封舱内和KO2反应后生成9 molO2,则反应前密封舱内H2O的量应该是______________。
(4)甲烷和水蒸气反应的产物是合成甲醇的原料:CH4+H2O![]() CO+3H2
CO+3H2
已知:CO+2H2![]() CH3OH CO2+3H2
CH3OH CO2+3H2![]() CH3OH+H2O
CH3OH+H2O
300 mol CH4完全反应后的产物中,加入100 mol CO2后合成甲醇。若获得甲醇350 mol,残留氢气120 mol,计算CO2的转化率_______
Ⅱ.氨碱法制纯碱包括石灰石分解、粗盐水精制、氨盐水碳酸化等基本步骤。完成下列计算:
(5)CaCO3质量分数为0.90的石灰石100 kg完成分解产生CO2_______L(标准状况)。石灰窑中,该石灰石100 kg与焦炭混合焙烧,产生CO2 29120 L(标准状况),如果石灰石中碳酸钙完全分解,且焦炭完全燃烧,不产生CO,则焦炭的物质的量为_______mol。
(6)已知粗盐水含MgCl2 6.80 mol/m3,含CaCl2 3.00mol/m3。向粗盐水中加入Ca(OH)2除镁离子:MgCl2 + Ca(OH)2 → Mg(OH)2↓ + CaCl2然后加入Na2CO3除钙离子。处理上述粗盐水10 m3,至少需要加Na2CO3______g。如果用碳酸化尾气(含NH3体积分数为0.100、CO2体积分数0.040)代替碳酸钠,发生如下反应:Ca2+ + 2NH3 + CO2 + H2O → CaCO3↓ + 2NH4+处理上述10 m3粗盐水至少需要通入_____________L(标准状况)碳酸化尾气。
(7)某氨盐水含氯化钠1521 kg,通入二氧化碳后析出碳酸氢钠晶体,过滤后溶液中含氯化铵1070 kg。
①过滤后溶液中氯化钠的质量______________。
②析出的碳酸氢钠晶体的质量__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:
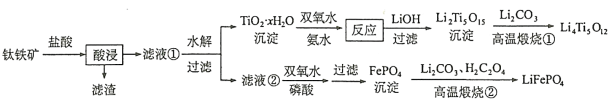
回答下列问题:
(1)Li2Ti5O15中Ti的化合价为+4,其中过氧键的数目为__________________。
(2)酸浸后,钛主要以TOCl42-形式存在,写出相应反应的离子方程式_________________。
(3)甲组同学取2 mL FeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为_________________________________________
丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为____________;
(4)+6价铬的化合物毒性较大,常用NaHSO3将废液中的Cr2O72-还原成Cr3+,反应的离子方程式为___________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】Cu2O可用于制作船底防污漆,某学习小组探究制备Cu2O的方法。
(查阅资料)① CuSO4与Na2SO3溶液混合可制备Cu2O。② Cu2O为砖红色固体;酸性条件下生成Cu2+和Cu。
③ Cu2O和Cu(SO3)23-可以相互转化 Cu2O![]() Cu(SO3)23-(无色)
Cu(SO3)23-(无色)
(1)配制0.25 mol·L-1CuSO4溶液和0.25 mol·L-1 Na2SO3溶液。测得CuSO4溶液pH=4,Na2SO3溶液pH=9。用离子方程式表示CuSO4溶液pH=4的原因_______。
(2)完成CuSO4溶液和Na2SO3溶液反应制Cu2O的离子方程式: ____Cu2++ ____SO32-+ ____ =____Cu2O↓+ ____ + ____HSO3-
(实验探究)
操作 | 现象 |
| i 有黄色沉淀出现,随着 Na2SO3溶液的滴入,沉淀增加,当加到5 mL时,溶液的蓝色消失。 ii 将试管加热,黄色沉淀变为砖红色,有刺激性气味气体产生。 iii在加热条件下,继续滴入Na2SO3溶液,砖红色沉淀减少,当1加到10 mL时,沉淀完全溶解,得无色溶液。 |
(3)证明ii中砖红色沉淀是Cu2O的实验方案是_______。
(4)经检验i中黄色沉淀含有Cu2SO3,ii中沉淀由黄色变砖红色的化学方程式是______。
(5)iii中砖红色沉淀消失的原因是_______。
(6)在加热条件下,若向2 mL 0.25 mol·L-1Na2SO3溶液中滴加0.25 mol·L-1CuSO4溶液至过量,预期观察到的现象是_______。
(7)由上述实验得出结论:CuSO4溶液和Na2SO3溶液反应制备Cu2O,应控制的条件是_______、_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上用废铁渣(含Fe2O3、FeO、Al2O3、MnO2、CuO、SiO2等杂质)制备绿矾(FeSO4·7H2O)并回收Cu的流程如图:

请回答下列问题:
(1)操作II所需的玻璃仪器有烧杯、玻璃棒和___。
(2)NaOH溶液的作用是溶解废铁渣中的___和___。
(3)写出向滤液2中加入铁粉的有关反应的离子方程式___(任写一个)。
(4)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化。由此可知___。
查看答案和解析>>
科目: 来源: 题型:
【题目】“氮的固定”对保障人类生存具有重大意义。一种新型合成氨的原理如图所示:
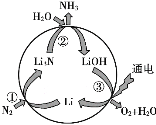
(1)N2的电子式:_____。
(2)Li3N中含有的化学键类型是_____。
(3)热稳定性:NH3_____H2O(填“>”或“<”)。
(4)NH3 、H2O分子中化学键极性更强的是_____,从原子结构角度解释原因:_____。
(5)写出右图所示过程的总反应方程式:_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】二氧化氯(ClO2)是一种新型消毒剂,可用氯酸钠(NaClO3)为原料制备。
(1)隔膜电解法制备ClO2的装置示意图如下:
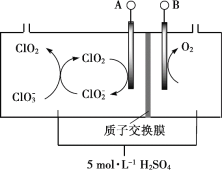
已知:ClO2在酸性溶液中比较稳定,在碱性溶液中不能稳定存在。
①产生O2的电极反应式:________。
②结合反应方程式,简述ClO2的产生过程:_________。
(2)过氧化氢还原法制备ClO2:![]() 研究发现Cl-对上述反应有影响,实验记录如下:
研究发现Cl-对上述反应有影响,实验记录如下:
加入NaCl 的浓度/(g·L1) | ClO2的生成速率/(g·L-1·min-1) | 相同时间 | |||
10 min | 30 min | 60 min | ClO2 产率/% | Cl2 的量 | |
0 | 0.0035 | 0.0124 | 0.0159 | 97.12 | 极微量 |
1.00 | 0.0138 | 0.0162 | 0.0163 | 98.79 | 极微量 |
①NaCl的主要作用是_______。
②上述反应可能的过程如下:
反应i:![]() +
+ ![]() + +
+ +
反应ii: Cl2 + H2O2 = 2Cl- + O2↑ + 2H+
将反应i填写完整_________。
③进一步研究发现,未添加Cl-时,体系中首先会发生反应生成Cl-,反应为:ClO3- + 3H2O2 = Cl- + 3O2↑+3H2O(反应iii)。分析反应i、ii、iii的速率大小关系并简要说明理由:_________。
(3)国家规定,饮用水中ClO2的残留量不得高于0.8 mg·L-1,检测步骤如下:
Ⅰ.取1.0L的酸性水样,加入过量的碘化钾,再用氢氧化钠溶液调至中性,使ClO2转化为![]() 。加入淀粉溶液,溶液变蓝。
。加入淀粉溶液,溶液变蓝。
Ⅱ.用0.0010 mol/LNa2S2O3溶液滴定步骤I中产生的I2。已知:步骤II中发生反应的离子方程式是![]()
①步骤I中发生的氧化还原反应的离子方程式是________。
②当步骤II中出现________(填现象)时,停止滴加Na2S2O3溶液,记录其体积为10.00 mL。
③上述水样中ClO2的残留浓度是______mg·L-1。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A. 氯气溶于水:Cl2+H2O=2H++Cl-+ClO-
B. Na2CO3溶液中CO32-的水解:CO32-+H2O=HCO3-+OH-
C. 酸性溶液中KIO3与KI反应生成I2:IO3-+I-+6H+=I2+3H2O
D. NaHCO3溶液中加足量Ba(OH)2溶液:HCO3-+Ba2++OH-=BaCO3↓+H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】将下列物质进行分类:①![]() H与
H与![]() H②O2与O3③乙醇与二甲醚(CH3-O-CH3)④CH3CH2CH2CH3与
H②O2与O3③乙醇与二甲醚(CH3-O-CH3)④CH3CH2CH2CH3与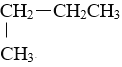 ⑤C60与C70
⑤C60与C70
(1)互为同位素的是______(填编号,下同);
(2)互为同素异形体的是______
(3)互为同分异构体的是______
(4)属于同一种物质的是________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com