
科目: 来源: 题型:
【题目】1,3-丁二烯A可用于合成CR橡胶和医药中间体K,其中合成K的线路如下:
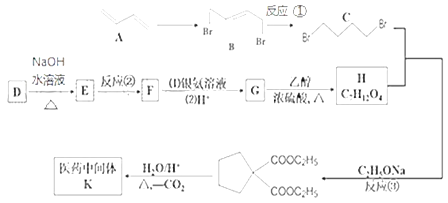
已知:
I.氯代烃D的相对分子质量是113,氯的质量分数约为62.8%,核磁共振氢谱峰面积之比为2:1。
Ⅱ. R-CH2COOH
R-CH2COOH
(1)B中所含的官能团有__________,E的系统命名法名称是__________。
(2)反应②的条件是__________,依次写出①和③的反应类型__________、__________。
(3)写出G→H过程中反应的化学方程式________。
(4)K的结构简式为__________。
(5)写出比G多2个碳原子的同系物的所有同分异构体的结构简式__________。
(6)以A为起始原料,选用必要的无机试剂合成CR橡胶![]() 。线路如下
。线路如下
参照上述流程,请完善虚线合成过程__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物A是一种重要的化工原料,A的产量可以用来衡量一个国家的石油化工水平。A在一定条件下可以合成聚合物B,B可作食品包装袋。请回答下列问题:
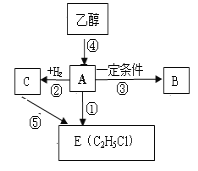
(1)A的结构简式是_________;反应③的反应类型为:____________ 。
(2)写出反应③、④的化学方程式反应③:________________________________________;
反应④:_________________________________________;
(3)乙烯作为重要的有机原料,工业上常用来制取乙醇,试写出该反应的化学方程式_____________。
(4)乙醇作为重要的有机原料,可以制取乙醛、乙醚等重要的有机物,试写出乙醇催化氧化制取
乙醛的化学方程式___________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学为探究MnO2与浓盐酸的反应,用如图所示的装置进行实验。
(1)B是用来收集气体的装置,但未将导管画全,请在装置图中将导管补画完整。_________
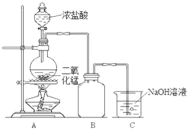
(2)制备实验开始时,先检查装置气密性,接下来的操作依次是_________(填字母)。
A.往烧瓶中加入MnO2粉末 B.加热 C.往烧瓶中滴加浓盐酸
(3)实验中该同学取8.7g MnO2和50mL 12mol/L浓盐酸在圆底烧瓶中共热,直到反应停止,最后发现烧瓶中还有固体剩余,该同学还检测到有一定量的盐酸剩余。
①MnO2与浓盐酸反应的化学方程式为_________。
②为什么有一定量的盐酸剩余但未能使MnO2完全溶解?_________。
③下列试剂中,能证明反应停止后烧瓶中有盐酸剩余的是_________(填字母)。
A.硝酸银溶液 B.碳酸钠溶液 C.氯化钠溶液
(4)为了测定反应残余液中盐酸的浓度,该同学设计了两个实验方案:
方案一:将A中产生的气体缓缓通过已称量的装有足量NaOH溶液的洗气瓶,反应停止后再次称量,两次质量差即是Cl2的质量,据此可求剩余盐酸的量。
方案二:当MnO2与浓盐酸的反应结束后,在装置A中加入足量的锌粉,用排水法测得产生H2的体积为V L(已换算为标准状况下)。
①实际上方案一不合理,原因为_________。
②根据方案二,写出剩余盐酸的物质的量浓度的计算式(假设反应前后溶液的体积保持不变)_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知1-溴丙烷在不同条件下的反应及各物质转化关系如图所示:

(1)D物质的结构简式为_____________,试写出反应②的化学反应方程式:________________。
(2)有机物A可以金属钠反应,试写出该反应的化学方程式_______________________________。
(3)B物质中可能含有的官能团是_________________。检验该官能团常用以下哪种试剂________
A. 浓硫酸 B.NaOH溶液 C.无水硫酸铜 D.新制氢氧化铜悬浊液
该反应的原理是____________________________________________(用化学方程式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图为原电池装置示意图:
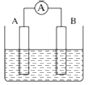
(1)将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,负极分别为______。
A.铝片、铜片 B.铜片、铝片 C.铝片、铝片 D.铜片、铜片
写出插入烧碱溶液中形成原电池的负极反应式_________。
(2)若A为Pb,B为PbO2,电解质为硫酸溶液,写出B电极反应式:_________;该电池在工作时,A电极的质量将______(填“增重”或“减轻”或“不变”)。若消耗0.1moLH2SO4时,则转移电子数目为______。
(3)若A、B均为铂片,电解质为KOH溶液,分别从A、B两极通入H2和O2,该电池即为氢氧燃烧电池,写出A电极反应式:_________;该电池在工作一段时间后,溶液的碱性将______(填“增强”或“减弱”或“不变”)。
(4)若A、B均为铂片,电解质为硫酸溶液,分别从A、B两极通入CH4和O2,该电池即为甲烷燃烧电池,写出A电极反应式:_________;电池工作时阴离子定向移动到______极(填“正”或“负”)。
(5)铁、铜、铝是生活中使用广泛的金属,FeCl3溶液常用于腐蚀印刷电路铜板,其反应过程的离子方程式为_________,若将此反应设计成原电池,则负极所用电极材料为______,正极反应式为_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在新型冠状病毒疫情中常用84消毒液进行消毒,有效成分为NaClO溶液,其主要是基于次氯酸(HClO)的氧化性。氯所在的卤族元素在生产生活中有广泛应用,回答以下问题:
(1)基态氯原子的核外价电子排布式为__________,HClO分子中中心原子的杂化轨道类型为__________。
(2)生产农药的原料PSCl3中,P、S、Cl的电负性由大到小的顺序为_________。
(3)①与Cl相邻的元案S、F,其化化物SF6被广泛用作高压电气设备的绝缘介质。SF6是一种共价化合物,可通过类似于Born-Haber循环能量构建能量图(a)计算相关键能,则S-F键的键能为__________。
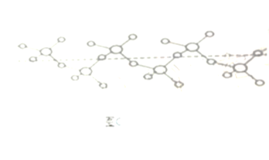
②硫和氧形成的链状化合物结构如图(C),其化学式为__________。

(4)CuCl的熔点为426℃,熔化时几乎不导电;CuF的熔点为908℃。
①CuF的熔点比CuCl的高,原因是_________。
②工业上将CuCl溶入KCN溶液中配制成镀铜液,镀铜液中配合物化学式为__________,写出一种与配体互为等电子体的阳离子的电子式__________。
③CuF晶胞如图(b),晶胞边长为a nm。则Cu+与F-最近的距离为________。用Mg·mol-1表示CuF的摩尔质量,NA表示阿伏加德罗常数的值,则CuF晶体的密度为______g·cm-3。
④以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图(b)中离子1的坐标为(![]() ,
,![]() ,0),则离子3的坐标为__________。
,0),则离子3的坐标为__________。
查看答案和解析>>
科目: 来源: 题型:
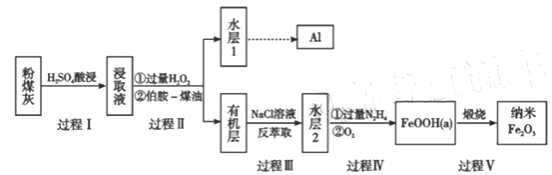
【题目】粉煤灰是燃煤产生的重要污染物,主要成分有Al2O3、Fe2O3、Fe3O4和SiO2等物质。综合利用粉煤灰不仅能够防止环境污染,还能获得纳米Fe2O3等重要物质。
已知:
i)伯胺R-NH2能与Fe3+反应;3R-NH2+Fe3++SO42-+H2O![]() Fe(NH2-R)3(OH)SO4+H+生成易溶于煤油的产物。
Fe(NH2-R)3(OH)SO4+H+生成易溶于煤油的产物。
ii)Fe3+在水溶液中能与Cl-反应:Fe3++6Cl-![]() [FeCl6]3-,回答下列问题:
[FeCl6]3-,回答下列问题:
(1)过程I对煤粉灰进行酸浸过滤后,滤渣的主要成分是_________。
(2)写出过程II加入过量H2O2发生的离子方程式_________。加入伯胺-煤油对浸取液进行分离,该操作的名称是_________。
(3)从化学平衡角度解释过程III利用NaCl溶液进行反萃取的原理________。
(4)过程IV中过量的N2H4将水层2中[FeCl6]3-转化为Fe2+,得到的Fe2+再被O2氧化为FeOOH,其中第一步的离子方程式为4[FeCl6]3-+5N2H4=4Fe2++N2+.4N2H5++24Cl-,该反应中氧化剂与还原剂的物质的量之比为_________。
(5)在常压用纳米Fe2O3电化学法合成氨的装置如图所示。

已知电解液为熔融NaOH-KOH,纳米Fe2O3在阴极发生电极反应分两步进行:该电解池第二步:2Fe+N2+3H2O=Fe2O3+2NH3。则该电解池第一步发生反应的方程式为_________。纳米Fe2O3在电解过程中所起的作用是_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)往2L密闭容器中充入1molN2和3molH2,在一定条件下发生合成氨反应,2min时达到平衡。测得平衡混合气体中NH3的体积分数为25%,则:
①0~2min内,v(NH3)=_________。
②H2在平衡混合气中的体积分数=_________。
③平衡时容器的压强与起始时的压强之比为_________。
(2)某温度时,在一个5L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示。根据图中数据填空:

①该反应的化学方程式为_____________。
②2min反应达平衡容器内混合气体的平均相对分子质量比起始时____________(填“大”,“小”或“相等”下同),混合气体密度比起始时____________。
③上述反应在第2min时,X的转化率为_________
④将amolX与bmolY的混合气体发生上述反应,反应到某时刻各物质的量恰好满足:n(X)=n(Y)=n(Z),则原混合气体中a:b=__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】将一定量纯净的氨基甲酸铵(NH2COONH4)置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g),下列可以判断该分解反应已经达到化学平衡状态的是( )
2NH3(g)+CO2(g),下列可以判断该分解反应已经达到化学平衡状态的是( )
A. 2v(NH3)=v(CO2) B. 密闭容器中总压强不变
C. 密闭容器中混合气体的平均摩尔质量不变 D. 密闭容器中氨气的体积分数不变
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、W 有如图所示的转化关系,则 X、W可能的组合有()
![]()
①C、O2②Na、O2③Fe、HNO3④S、O2⑤N2、O2⑥H2S、O2⑦NH3、O2
A.四项B.五项C.六项D.七项
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com