
科目: 来源: 题型:
【题目】某同学为了验证碳和硅两种元素非金属性的相对强弱,用图示装置进行实验(夹持仪器已略去,气密性已检验)。
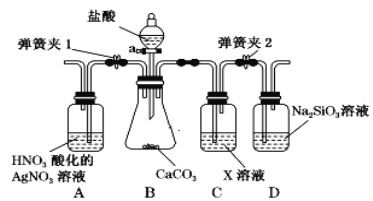
回答下列问题:
(1)仪器a的名称:___________________。
(2)打开弹簧夹1,关闭弹簧夹2,旋开仪器a的活塞滴加盐酸。一段时间后,A中现象是________;原因是________。
(3)关闭弹簧夹1,打开弹簧夹2,D中出现白色胶状沉淀,X是________(填化学式),D中发生反应的化学方程式是___________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。CO2可转化成有机物实现碳循环。在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示。

(1)从3 min到9 min,υ(CO2)=______mol·L-1·min-1
(2)能说明上述反应达到平衡状态的是____________(填编号)
A.反应中CO2与CH3OH的物质的量浓度之比为1∶1(即图中交叉点)
B.混合气体的压强不随时间的变化而变化
C.单位时间内生成1 mol H2,同时生成1 mol CH3OH
D.混合气体的平均相对分子质量不随时间的变化而变化
(3)平衡时CO2的转化率为________%
(4)平衡混合气体中CO2(g)和H2(g)的质量之比是____________。
(5)第3 min时υ正(CH3OH)___________第9 min时υ逆(CH3OH)(填“>”、“<”或“=”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下,某反应达到了化学平衡,其反应过程对应的能量变化如图。下列说不正确的是

A.Ea为催化剂存在下该反应的活化能,Ea′为无催化剂时该反应的活化能
B.该反应为放热反应,△H=Ea-Ea′
C.活化分子是能最较高、有可能发生有效碰撞的分子
D.催化剂是通过降低反应所需的活化能来同等程度的增大正逆反应速率,使平衡不移动
查看答案和解析>>
科目: 来源: 题型:
【题目】钠、铁、镁等元素在生产生活中有广泛的用途,完成下列填空:
Ⅰ钠的重要化合物
(1)在水产养殖上,硫代硫酸钠常用于除去自来水中的氯气,理论上,去除1g的氯气需要0.56g硫代硫酸钠,反应的离子方程式为______。
(2)除去Al2O3中混有的Fe2O3,可将混合物溶于过量的盐酸,再加入Na2CO3调节pH使Fe3+沉淀完全而Al3+不沉淀,用化学用语及相应的离子方程式解释加入Na2CO3的目的______。
Ⅱ铁的重要化合物
(3)磷酸铁(FePO42H2O是难溶于水的米白色固体)可用于生产药物、食品添加剂和锂离子电池的正极材料。实验室可通过下列实验制备磷酸铁。
①称取一定量已除去油污的废铁屑,加入稍过量的稀硫酸,加热、搅拌,反应一段时间后过滤,反应加热的目的是______。
②向滤液中加入一定量H2O2氧化Fe2+,为确定加入H2O2的量,需先用K2Cr2O7标准溶液滴定滤液中的Fe2+,在向滴定管中注入K2Cr2O7标准溶液前,滴定管需要检漏、______和______。
③将一定量的Na2HPO4溶液(溶液显碱性)加入到含有Fe3+的溶液中,搅拌、过滤、洗涤、干燥得到FePO42H2O.若反应得到的FePO4H2O固体呈棕黄色,则磷酸铁中混有的杂质可能为______。
Ⅲ镁的重要化合物
(4)氧化镁和碳粉与氯气在一定条件下反应可制备氯化镁,若尾气可用足量的氢氧化钠溶液完全吸收,则生成的盐为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①~⑨在表中的位置,回答下列问题:
族 周期 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ | ||||
(1)①④⑥三种元素构成的化合物的电子式:__;⑨的最高价氧化物对应水化物的化学式:__。
(2)⑤、⑦、⑧的简单离子半径由大到小的顺序:__(用离子符号填写)。
(3)用一个化学方程式表示④、⑤二种元素非金属性的强弱__。
(4)⑦的单质与⑥的最高价氧化物对应水化物的水溶液反应的离子方程式为__。
(5)元素①、元素④以原子个数比为1∶1形成化合物Q,元素①、元素③形成化合物M,Q和M的电子总数相等。以M为燃料,Q为氧化剂,可作火箭推进剂,最终产物对空气没有污染,写出该反应的化学方程式:__。
查看答案和解析>>
科目: 来源: 题型:
【题目】某学生验证浓硫酸性质的实验如图。下列叙述错误的是
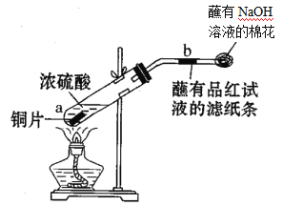
A.反应一段时间后,b处滤纸条褪色
B.蘸有NaOH溶液的棉花团作用是吸收多余的SO2,防止污染空气
C.化学反应方程式:Cu+2H2SO4(浓)=CuSO4+SO2↑+2H2O
D.硫酸型酸雨形成的可能原因是:SO2+H2O![]() H2SO3;O2+2H2SO3=2H2SO4
H2SO3;O2+2H2SO3=2H2SO4
查看答案和解析>>
科目: 来源: 题型:
【题目】反应C(s)+H2O(g)![]() CO(g)+H2(g)在一定容积的密闭容器中进行,则下列说法或结论中,能够成立的是
CO(g)+H2(g)在一定容积的密闭容器中进行,则下列说法或结论中,能够成立的是
A.v(CO)=v(H2O)时,反应达到平衡状态
B.保持体积不变,充入少量He气体使体系压强增大,反应速率一定增大
C.其他条件不变,仅将容器的体积缩小一半,反应速率加快
D.其他条件不变,适当增加C(s)的质量会使反应速率增大
查看答案和解析>>
科目: 来源: 题型:
【题目】将1.76g铜镁合金完全溶解于一定浓度的硝酸中,得到NO和NO2标准状况下896mL的混合气体,向反应后的溶液中加入lmol/L的NaOH溶液,当金属离子全部沉淀时,得到3.12g沉淀。下列说法不正确的是
A. 合金中铜镁物质的最之比为1:1
B. 产生的NO和NO2的体积之比为1:1
C. 得到3.12g沉淀时,加入NnOH溶液体积一定是80mL
D. 1.76g该合金与足量盐酸反应,可生成标准状况下448mL气体
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下向10 mL 0.1 mol·L-1NaOH溶液中加入0.1 mol·L-1的一元酸HA,溶液pH的变化曲线如图所示。下列说法正确的是( )

A. a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA)
B. a点溶液蒸发(不考虑溶质析出)c(Na+)/c(A-)增大
C. pH=7时,c(Na+)=c(A-)+c(HA)
D. b点所示溶液中c(A-)>c(HA)
查看答案和解析>>
科目: 来源: 题型:
【题目】采用阴离子交换法合成了一系列不同 Zn 和 Pt 含量的PtSn-Mg(Zn)AlO催化剂用于乙烷脱氢反应[CH3CH3(g)CH2 = CH2 (g)+H2(g) △H>0],实验结果表明,在水滑石载体中掺杂少量的 Zn 对乙烷脱氢反应有明显影响,如图所示为不同Zn含量PtSn催化剂的乙烷催化脱氢反应中,乙烷的转化率随时间的变化。下列说法不正确的是( )
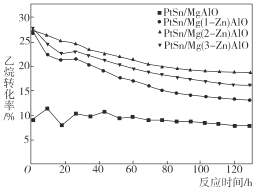
A.由图可知,PtSn/Mg(2-Zn)AlO催化剂的催化反应活性最优
B.一定温度下,将nmol乙烷放入VL密闭容器中进行催化脱氢,维持容器体积不变,测得乙烷平衡转化率为a,则该温度下反应的平衡常数K=![]()
C.升高温度,平衡逆向移动
D.随着反应时间的延长,乙烷转化率逐渐稳定,催化活性保持在相对稳定的阶段
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com