
科目: 来源: 题型:
【题目】今年是门捷列夫发现元素周期律150周年。下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法错误的是
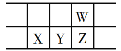
A. 原子半径:W<X
B. 常温常压下,Y单质为固态
C. 气态氢化物热稳定性:Z<W
D. X的最高价氧化物的水化物是强碱
查看答案和解析>>
科目: 来源: 题型:
【题目】在一个不传热的固定容积的密闭容器中,发生可逆反应mA(g)+nB(g)![]() pC(g)+qD(s),当
pC(g)+qD(s),当
m、n、p、q为任意整数时,反应达到平衡的标志是( )
①体系的压强不再改变 ②体系的温度不再改变 ③体系的密度不再变化 ④各组分质量分数不再改变
A. ①②③ B. ①②④ C. ②③④ D. ①③④
查看答案和解析>>
科目: 来源: 题型:
【题目】下列热化学方程式中△H的绝对值能表示可燃物的燃烧热的是( )
A.H2(g)+Cl2(g)=2HCl(g) △H=-184.6kJ/molB.C(s)+![]() O2(g)=CO(g) △H=-110.5kJ/mol
O2(g)=CO(g) △H=-110.5kJ/mol
C.2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ/molD.CO(g)+![]() O2(g)=CO2(g) △H=-283kJ/mol
O2(g)=CO2(g) △H=-283kJ/mol
查看答案和解析>>
科目: 来源: 题型:
【题目】某课外兴趣小组成员为研究金属铜与强酸的反应 ,将6.4g铜粉分为两等份,进行了如下实验,请完成有关计算。
(1)取其中一份铜粉投入200mL氢离子浓度为 1molL-1 硫酸和硝酸混合液中,微热使反应充分完成后,生成一氧化氮气体448mL(标准状况)。则反应前混合溶液中硫酸的物质的量浓度为_________(写出计算过程)。
(2)用NaOH溶液吸收氮氧化物是防止NO2污染的一种方法。原理为2NO2 + 2NaOH=NaNO3 + NaNO2 + H2O,NO + NO2 + 2NaOH=2NaNO2 + H2O。取另一份铜粉溶于过量的硝酸溶液,假设硝酸的还原产物只有一氧化氮和二氧化氮,生成的混合气体能被amol NaOH溶液完全吸收,试讨论a的取值范围:_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)甲苯与浓硫酸、浓硝酸在100℃时能获得不溶于水的淡黄色针状晶体,请写出反应方程式:__________。上述反应是加成反应还是取代反应?请判断并说明原因:__________________。
(2)Mg3N2是离子化合物,各原子均满足8电子稳定结构,写出Mg3N2的电子式:__________。
(3)在常压下,乙醇在水中的溶解度比溴乙烷在水中的溶解度大,主要原因是______。
查看答案和解析>>
科目: 来源: 题型:
【题目】酮洛芬是一种良好的抗炎镇痛药,可以通过以下方法合成:

(1)化合物D中所含官能团的名称为___和____。
(2)化合物E的结构简式为__________;由B→C的反应类型是____
(3)写出C→D的反应方程式:_____________________。
(4)B的同分异构体有多种,其中同时满足下列条件的有____种。
Ⅰ.属于芳香族化合物 Ⅱ.能发生银镜反应Ⅲ.其核磁共振氢谱有5组峰,且面积比为1∶1∶1∶1∶3
查看答案和解析>>
科目: 来源: 题型:
【题目】氮化铝(AlN)是一种新型无机材料,工业上由氧化铝与焦炭在氮气流中高温制得,产品中常含有Al4C3、C和Al2O3等杂质。某实验小组为测定a g工业氮化铝样品中AlN的质量及Al4C3的质量分数,设计了如下装置,已知装置B、C、D中的药品均足量。

已知:①AlN和Al4C3均能与水反应,分别生成NH3和CH4。②CH4能与CuO发生反应:CH4+4CuO![]() 4Cu+CO2+2H2O。
4Cu+CO2+2H2O。
(1)写出锥形瓶中发生反应的化学方程式。AlN与H2O反应:__________;Al4C3与H2O反应:____________。
(2)有下列操作步骤:①缓缓鼓入一定量的N2;②称量C和D(酒精灯和铁架台等除外)的质量,按顺序组装仪器,检查装置的气密性,将样品放入锥形瓶中;③点燃D处酒精灯;④再次称量C和D的质量;⑤从分液漏斗缓缓滴入水,直到不再产生气体时为止;⑥再次缓缓鼓入一定量的N2。正确的操作顺序是_________。
(3)C的作用是吸收氨气,则C中所盛试剂的最佳选择是________(填代号)。
A.蒸馏水 B.浓硝酸C.浓盐酸 D.浓硫酸
(4)A中反应结束后,还要通入一段时间的N2至D中固体恢复到室温,其目的是_______(写两条)。
(5)实验结束后,测得反应后D中固体质量减少m g,C中增加n g,则a g样品中AlN的质量为________g,Al4C3的质量分数为________×100%。
查看答案和解析>>
科目: 来源: 题型:
【题目】某固体样品可能含有K+、Ca2+、NH4+、Cl-、CO32-、SO42-中的几种离子。将该固体样品分为等质量的两份,进行如下实验(不考虑盐类的水解及水的电离):(1)一份固体溶于水得无色透明溶液,加入足量BaCl2溶液,得沉淀6.63g,在沉淀中加入过量稀盐酸,仍有4.66g沉淀。(2)另一份固体与过量NaOH固体混合后充分加热,产生使湿润的红色石蕊试纸变蓝色的气体0.672L(标准状况)(假设气体全部逸出)。下列说法正确的是
A.该固体中一定含有NH4+、CO32-、SO42-、Cl-
B.该固体中一定没有Ca2+、Cl-,可能含有K+
C.该固体可能由(NH4)2SO4、K2CO3和NH4Cl组成
D.该固体中n(K+)≥0.06mol
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)按图装置进行实验。请回答下列问题:
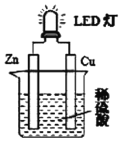
①以下叙述错误的是_______________(填字母)。
A.铜片是正极,表面有气泡产生
B.装置中存在“化学能→电能→光能”的转化
C.外电路中电流方向Zn→Cu
D.溶液中SO42-向铜片方向移动
②实验发现不仅在铜片上有气泡产生,在锌片上也有气泡产生。分析锌片上产生气泡的原因是_______________________。
③实验中当负极材料消耗质量为2.6g时,则电路中转移电子数为___________。
(2)某种燃料电池的工作原理示意如图所示,a、b均为惰性电极。
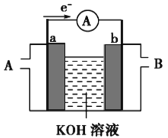
①电池工作时,空气从_____口通入(填“A”或“B”);
②若使用的燃料为氢气(H2),a极的电极反应式为_____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】硫和氮的氧化物直接排放会引发严重的环境问题,请回答下列问题:
Ⅰ.SO2的排放主要来自于煤的燃烧。常用石灰石脱硫,其产物可以做建筑材料。
已知:CaCO3(s)=CO2(g)+CaO(s) ΔH=+178.2kJ/mol
SO2(g)+CaO(s)=CaSO3(s) ΔH=-402kJ/mol
2CaSO3(s)+O2(g)=2CaSO4(s) ΔH=-234.2kJ/mol
写出石灰石脱硫的热化学反应方程式___________________________。
Ⅱ.在一定温度下的恒容容器中,反应2N2O(g)=2N2(g)+O2(g)的部分实验数据如下:
反应时间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
c(N2O) /mol·L-1 | 0.100 | 0.090 | 0.080 | 0.070 | 0.060 | 0.050 | 0.040 | 0.030 | 0.020 | 0.010 | 0.000 |
①在0~20min 时段,反应速率υ(N2O)为_____。
②若N2O起始浓度c0为0.150mol·L-1,则反应至30min时N2O的转化率α=____,比较不同起始浓度时N2O的分解速率:υ(c0=0.150mol·L-1)____υ(c0=0.100 mol·L-1)(填“>、=或<”)
③不同温度(T)下,N2O分解半衰期随起始压强的变化关系如图所示(图中半衰期指任一浓度N2O耗一半时所需的相应时间),则T1__T2(填“>、=或<”)。当温度为T1、起始压强为p0,反应至t1min时,体系压强p=__(用 p0表示)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com