
科目: 来源: 题型:
【题目】高纯度单晶硅是典型的无机非金属材料,又称“半导体”材料.它的发现和使用曾引起计算机的一场“革命”。它可以按下列方法制备:
SiO2![]() Si(粗)
Si(粗)![]() SiHCl3
SiHCl3![]() Si(纯)
Si(纯)
下列说法正确的是()
A.步骤①的化学方程式为:SiO2+C![]() Si+CO2↑
Si+CO2↑
B.SiO2既能与HF反应,又能与NaOH反应,所以SiO2属于两性氧化物
C.高纯硅是制造太阳能电池的常用材料,二氧化硅是制造光导纤维的基本原料
D.含硅化合物硅酸钠属于盐类,不属于碱,可以保存在磨口玻璃塞试剂瓶中
查看答案和解析>>
科目: 来源: 题型:
【题目】我国科学家成功实现甲烷在催化剂及无氧条件下,一步高效生产乙烯、芳香烃和氢气等化学用品,为天然气化工开发了一条革命性技术。以甲烷为原料合成部分化工产品流程如图(部分反应产物及条件已略去):

已知:R—Cl![]() R—OH
R—OH
回答下列问题:
(1)A物质所含官能团的名称是___,反应⑥要发生需要试剂有__。
(2)M的结构简式是__,大量使用M产品会对环境造成的危害是__。
(3)反应③的化学方程式是___。
(4)化合物N在医疗上可以作为局部麻醉剂,N的化学名称是___。
(5)反应④的化学方程式是__;反应类型属于__反应。
(6)下列物质中,不能通过乙烯加成反应得到的是____(填序号)。
a.CH3CH3 b.CH3CHCl2 c.CH3CH2Br
查看答案和解析>>
科目: 来源: 题型:
【题目】某学习小组同学根据影响化学反应速率的因素进行实验验证,其设计的实验方案如下:请你帮他们把表填写完整,并做出评价。
(1)甲同学验证还原性:I->Br-
实验步骤 | 实验现象 | 实验结论及离子反应式 |
| 逐滴加入的同时振荡,观察CCl4层的颜色: 甲___ 乙___; 乙中CCl4层颜色明显变化的快。 | 离子方程式: 甲__ 乙__ 结论:验证成立,还原性,I->Br- |
(评价)甲同学设计的实验方案是__(填“合理”或“不合理”),理由是__。
(3)乙同学验证固体反应物的颗粒大小的对反应速率影响
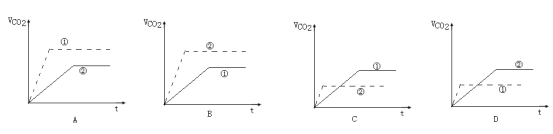
实验步骤:在试管①中加入1g粉末状大理石,加入4mol/L盐酸20mL(过量);在试管②中加入2g颗粒状大理石,加入4mol/L盐酸20mL(过量)。他根据实验过程,绘制出的生成CO2生成体积(折算成标准状况)V(CO2)同反应时间t的关系曲线图,你认为__是符合的。
查看答案和解析>>
科目: 来源: 题型:
【题目】乙酸乙酯是无色、具有果香气味的液体。某同学采用12.0mL96%密度为1.05g/mL的乙酸、23mL95%密度为0.75g/mL的乙醇、12.0mL浓硫酸、饱和Na2CO3溶液制备乙酸乙酯,其实验装置如图所示(烧杯、部分夹持装置、温度计已略去)。
已知:①氯化钙可与乙醇形成难溶于水的CaCl2·6C2H5OH
②有关有机物的沸点:
试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
沸点(℃) | 34.7 | 78.5 | 117.9 | 77.2 |
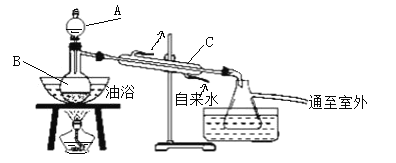
①先向蒸馏烧瓶B中加入试剂__,然后通过仪器A慢慢加入__;
②加热保持油浴温度为135~145℃,至不再有液体流出后,停止加热;
③取带有支管的锥形瓶,将一定量的饱和Na2CO3溶液分批、少量、多次地加入馏出液中,再将混合物分液,弃去水层,得到有机层。
试回答下列问题:
(1)①蒸馏烧瓶B加入试剂__,然后通过仪器A慢慢加入__。
(2)写出制备乙酸乙酯的化学方程式__。
(3)仪器A的名称是__;浓硫酸的作用是__;仪器C的作用是__。
(4)反应中所用的乙醇是过量的,其目的是__。
(5)③中加入饱和碳酸钠溶液的作用__,分批、少量、多次地加入饱和碳酸钠的原因是__。
(6)从③中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入饱和氯化钙溶液分离出__,再加入无水硫酸钠,然后进行蒸馏,收集77.2℃的馏分,以得到纯净的乙酸乙酯9.2g,计算此实验中生成乙酸乙酯的产率为__(写出计算的表达式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式正确的是
A.钢铁吸氧腐蚀中的正极反应:4OH 4e-=2H2O +O2↑
B.工业上用电解法制铝:2AlCl3(熔融)![]() Al+3Cl2↑
Al+3Cl2↑
C.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:![]() + 6H+ + 5H2O2=2Mn2+ + 5O2↑ + 8H2O
+ 6H+ + 5H2O2=2Mn2+ + 5O2↑ + 8H2O
D.AgNO3 溶液中加入少量氨水;Ag+ + NH3·H2O = AgOH↓+ NH4+
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验的现象与结论相对应的是
A | B | C | D | |
实验 |
|
|
|
|
现象 | 电流计指针向右偏(电子由Fe转移到Cu),片刻后向左偏 | 加热一段时间后溶液蓝色褪去 | 加热,肥皂液中产生无色气泡 | 烧瓶中有大量气泡冒出,Na2SiO3溶液变浑浊 |
结论 | 铁片作负极,片刻后铜片作负极 | 淀粉在酸性条件下水解,产物是葡萄糖 | 铁粉与水蒸气反应生成H2 | 非金属性: N>C>Si |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】目前工业上有一种方法是用CO2生产燃料甲醇(CH3OH)。反应的化学方程式为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),该反应的能量变化如图所示:
CH3OH(g)+H2O(g),该反应的能量变化如图所示:
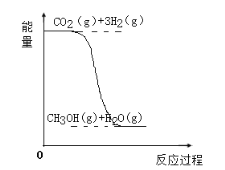
(1)该反应是__反应(填“吸热”或“放热”),判断的理由是___。
(2)某温度时,在体积为2L的密闭容器中,充入1molCO2和3molH2,测得CO2的物质的量随时间变化如下表所示:
时间/min | 0 | 2 | 5 | 10 | 15 |
n(CO2)/mol | 1 | 0.85 | 0.7 | 0.25 | 0.25 |
从反应开始到5min末,用CO2表示的该反应的平均速率为__;反应达平衡时,H2的转化率为__;要提高此反应的速率,可以采取___措施(填写2条)。
(3)若维持(2)的条件不变,能说明该反应已达平衡状态的是__(填序号)。
A.v生成(CH3OH)=v消耗(CO2)
B.CO2、H2、CH3OH、H2O浓度相等的状态
C.CO2、H2、CH3OH、H2O总物质的量保持不变的状态
D.CO2的转化率保持不变的状态
(4)依据原电池原理,将甲醇设计成燃料电池如图:
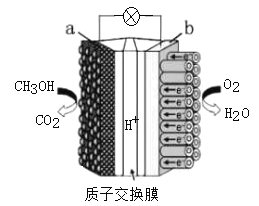
则a为__极(填“正”或“负”);H+从__极区向__极区迁移(用图中字母填);b极上O2发生反应电极反应式为:__。
查看答案和解析>>
科目: 来源: 题型:
【题目】我国自主研发的对二甲苯绿色合成项目取得新进展,其合成过程如图所示。

下列说法不正确的是
A. 异戊二烯所有碳原子可能共平面
B. 可用溴水鉴别M和对二甲苯
C. 对二甲苯的一氯代物有2种
D. M的某种同分异构体含有苯环且能与钠反应放出氢气
查看答案和解析>>
科目: 来源: 题型:
【题目】下面是元素周期表的结构,用化学用语完成下列问题。
① | |||||||||||||||||
② | ③ | ④ | |||||||||||||||
⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||||||||||||
(1)表中有编号的元素中化学性质最不活泼的,其原子结构示意图为__;④与⑤按照原子个数比1∶1形成的化合物中含有的化学键有___。
(2)①与②形成的最简单化合物的空间构型为__,将此化合物与⑧的单质混合于一干燥的集气瓶,密封后放在光亮处一段时间后,观察到的现象是__。
(3)由③形成的单质的电子式为__;⑤与⑦的最低价形成的化合物的电子式为__。
(4)⑧的最高价氧化物对应的水化物的化学式是___;①分别与④、⑦形成的简单化合物的稳定性由强到弱的顺序是__。
(5)④、⑥、⑧三种元素的原子形成的简单离子中半径由大到小的顺序是__。
(6)运用你掌握的化学理论,设计一个实验,证明⑦的非金属性比②强__(用化学方程式表示出反应原理)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A.0.1mol/L NaHSO3溶液pH=5.6,溶液中粒子浓度 c (HSO3-)> c (H2SO3)>c (SO32-)
B.将Na2CO3固体溶于水配成溶液,再向溶液中加水,由水电离出的c(H+)·c(OH-)增大
C.碳酸氢钠溶液中:c(OH-)+c(CO32-)=c(H+)+c(H2CO3)
D.等体积、等物质的量浓度的Na2CO3和NaHCO3溶液混合: <
<
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com