
科目: 来源: 题型:
【题目】某化学兴趣小组为了探究铝电极在电池中的作用,设计并进行了以实验结果记录如下:
编号 | 电极材料 | 电解质溶液 | 电流表指针偏转方向 |
1 | Al、Cu | 稀盐酸 | 偏向Cu |
2 | Al、C(石墨) | 稀盐酸 | 偏向石墨 |
回答下列(1)、(2)小题:
⑴实验1中Al作的电极为____(填“正极”或“负极”),Cu作的电极为____(填“正极"或“负极”)。
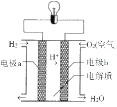
⑵实验2观察到C(石墨)棒上产生的现象是____,负极的电极反应式为____.如图是电解质为稀硫酸溶液的氢氧燃料电池。该电池的电子从电极____经过导线流向电极____(填a或b)
查看答案和解析>>
科目: 来源: 题型:
【题目】请阅读下列材料,回答下列小题,
人们曾认为N+3H![]() 2NH化学反应速率小,原材料利用率低,不可能用于工业化生产。化学家们不断地研究和改进该反应的条件,如催化制,温度、压强等,并更新设备,成功地开发了合成氨的生产工艺。从此,人类能为植物的生长提供足够的氮肥。道解了地球上有限的耕地资源与庞大的粮食需求之间的矛盾。
2NH化学反应速率小,原材料利用率低,不可能用于工业化生产。化学家们不断地研究和改进该反应的条件,如催化制,温度、压强等,并更新设备,成功地开发了合成氨的生产工艺。从此,人类能为植物的生长提供足够的氮肥。道解了地球上有限的耕地资源与庞大的粮食需求之间的矛盾。
(1)合成氨的反应属于___________
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
(2)下列反应条件的改变对反应速率的影响正确的是___________
A.增大N2的浓度能加快反应速率 B.减小H2的浓度能加快反应速率
C.升高温度能减慢反应速率 D.添加催化剂对反应速率无影响
(3)合成氨为放热反应,下列说法正确的是___________
A.断开H-H键放出能量
B.形成N-H键吸收能量
C.反应物的总能量大于生成物的总能量
D.反应物的总能量小于生成物的总能量
查看答案和解析>>
科目: 来源: 题型:
【题目】反应2SO2+O2![]() 2SO3,在一定温度下的定容容器中进行,下列说法正确的是
2SO3,在一定温度下的定容容器中进行,下列说法正确的是
A.反应达到限度时,各反应物和生成物的浓度之比等于化学计量数之比
B.反应达到限度时,SO2将全部转化为SO3
C.反应达到限度时,O2物质的量不再改变
D.反应达到限度时,v(正反应)=v(逆反应)=0
查看答案和解析>>
科目: 来源: 题型:
【题目】据世界权威刊物《自然》最近报道,我国科学家选择碲化锆(ZrTe2)和砷化镉(Cd3As2)为材料验证了三维量子霍尔效应,并发现了金属-绝缘体的转换。回答下列问题:
(1)锌和镉位于同副族,而锌与铜相邻。现有 4 种铜、锌元素的相应状态,①锌:[Ar]3d104s2、②锌:[Ar]3d104s1、③铜:[Ar]3d104s1、④铜:[Ar]3d10。失去1个电子需要的能量由大到小排序是______(填字母)。
A.④②①③ B.④②③① C.①②④③ D.①④③②
(2)硫和碲位于同主族,H2S的分解温度高于H2Te,其主要原因是_______。在硫的化合物中,H2S、CS2都是三原子分子,但它们的键角(立体构型)差别很大,用价层电子对互斥理论解释:_________;用杂化轨道理论解释:_________。
(3)Cd2+与NH3等配体形成配离子。[Cd(NH3)4]2+中2个NH3被2个Cl-替代只得到1种结构,它的立体构型是___________。1 mol [Cd(NH3)4]2+含___________mol σ键。
(4)砷与卤素形成多种卤化物。AsCl3、AsF3、AsBr3的熔点由高到低的排序为__________。
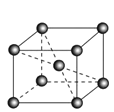
(5)锆晶胞如图所示,1个晶胞含_______个Zr原子;这种堆积方式称为__________。

(6)镉晶胞如图所示。已知:NA是阿伏加德罗常数的值,晶体密度为 d g·cm-3。在该晶胞中两个镉原子最近核间距为______nm(用含NA、d的代数式表示),镉晶胞中原子空间利用率为________(用含π的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】普通锌锰电池筒内无机物主要成分为MnO2、NH4Cl、ZnCl2等。某研究小组探究废于电池内的黑色固体并回收利用时,进行如图所示实验。下列有关实验的叙述正确的是
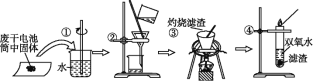
A. 操作①中玻璃棒的作用是转移固体 B. 操作②为过滤,得到的滤液显碱性
C. 操作③中盛放药品的仪器是坩埚 D. 操作④的目的是除去滤渣中的杂质
查看答案和解析>>
科目: 来源: 题型:
【题目】在标准状况下,将22.4LHCl完全溶于1L水中(水的密度近似为1g/mL),溶液的密度为ρg/cm3(ρ>1),溶液的体积为VmL,溶质的质量分数为w,溶质的物质的量浓度为c mol/L.下列叙述中正确的是( )
①w=![]() ×100% ②c=1molL﹣1 ③向上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5w④向上述溶液中再加入VmL水后,所得溶液的质量分数小于0.5w
×100% ②c=1molL﹣1 ③向上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5w④向上述溶液中再加入VmL水后,所得溶液的质量分数小于0.5w
A. ①②③B. ①③④C. ①③D. ①④
查看答案和解析>>
科目: 来源: 题型:
【题目】向mg镁和铝的混合物中加入适量的稀硫酸,恰好完全反应生成标准状况下的气体bL。向反应后的溶液中加入cmol/L氢氧化钾溶液VmL,使金属离子刚好沉淀完全,得到的沉淀质量为ng。再将得到的沉淀灼烧至质量不再改变为止,得到固体pg。则下列关系不正确的是
A. ![]() B.
B. ![]() C. n=m+17Vc D.
C. n=m+17Vc D. ![]() m<p<
m<p<![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】以二氧化碳为原料制备尿素工艺被广泛研究。其反应机理为:
反应Ⅰ:CO2(g)+2NH3(g)NH2COONH4(l) H1=-117.2 kJ·mol1
反应Ⅱ:NH2COONH4(l)NH2CONH2(l)+H2O(l) H2= +15.0 kJ·mol1
(1)反应Ⅰ平衡常数K的表达式为_____________。
(2)由CO2(g)和NH3(g)合成尿素NH2CONH2(l)的热化学方程式是__________。
(3)在恒容容器中按物质的量之比1∶2通入CO2和NH3,下列不能说明合成尿素反应达平衡状态的是_________。
A.容器中气体平均相对分子质量不再变化
B.容器中气体密度不再变化
C.NH3的体积分数不再变化
D.容器内压强不再变化
(4)通过实验发现,其他条件不变时,改变NH3、CO2的物质的量之比可增加尿素的产率,如图为 与尿素产率的关系曲线。通过曲线可知:______________过量对尿素产率的影响比较小。若在固定容器中按
与尿素产率的关系曲线。通过曲线可知:______________过量对尿素产率的影响比较小。若在固定容器中按 等于3.0通入CO2和NH3,则合成尿素反应达平衡后,混合气体中CO2的物质的量分数为________(精确到0.1%)。
等于3.0通入CO2和NH3,则合成尿素反应达平衡后,混合气体中CO2的物质的量分数为________(精确到0.1%)。

(5)探究发现,温度、压强、n(H2O)条件对合成尿素反应的影响如图1、图2,根据图像回答下列问题:

①其他条件不变时,对于合成尿素的反应,若通入CO2物质的量一定,按三种投料比[分别为 3.0、3.5、4.0]投料时,得到如图1的横轴对CO2的平衡转化率的影响曲线。曲线A对应的投料比是________。
②图2中a、b、c、d 四条曲线中的两条代表压强分别为20 MPa、25 MPa时CO2平衡转化率曲线,其中表示20MPa的是_________(填字母)。在实际生产中采用图2中M点而不是N点对应的反应条件,运用化学反应速率和平衡知识,同时考虑生产实际,说明选择该反应条件的主要原因是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】2020年爆发的新冠肺炎让漂白粉及漂白液的销量大增。请回答下面的问题:
(1)工业上常将氯气制成漂白粉,而不是制成次氯酸的原因是______________________,制漂白粉的化学方程式是________
(2)下列物质露置在空气中会变质,在变化过程中既有非氧化还原反应发生,又有氧化还原反应发生的是________。
A.生石灰 B.漂白粉C.NaOH D.Na2SO3
(3)写出下列两个化学方程式。
①漂白粉+稀盐酸:__________
②漂白粉+浓盐酸:_______________________
(4)用贮存很久的漂白粉与浓盐酸反应制得的氯气中,可能含有的杂质气体是_____(填序号)。
①HCl ②O2 ③CO2 ④H2O(g)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com